L'obésité : Un véritable enjeu de santé publique
L'obésité est un véritable fléau de santé publique dans les pays développés où sa prévalence est en constante augmentation. Elle est un facteur de risque cardio-vasculaire important, elle altère également l'espérance et la qualité de vie des patients.
L'obésité est définie par un excès de masse grasse, quantifiée par l'indice de masse corporelle (IMC) correspondant au rapport du poids (en kg) sur la taille (en mètre) au carré. La répartition corporelle du tissu graisseux est appréciée par le rapport taille/hanche ou par le tour de la taille : C'est le deuxième paramètre à prendre en compte, plus particulièrement vis-à-vis des complications.
- L'OMS (Organisation mondiale de la santé) définit les seuils
- IMC normale doit être comprise entre 18.5 et 25
- IMC < 18.5 : poids bas
- 25 < IMC < 30 : surpoids
- IMC > 30 : Obésité
- L'obésité est classée en 3 stades
- IMC entre 30 et 40 : obésité simple
- IMC entre 40 et 50 : obésité morbide
- IMC > 50 : super obésité
- Quelques chiffres
Entre 2001 et 2004, aux Etats-Unis, 66% de la population adulte souffraient de surpoids et 32% étaient obèses. Huit à 9 millions d'américains sont obèses morbides et ce taux augmente de 1% par an. Cinq à 7% de la population adulte sont considérés comme souffrant d'obésité morbide.
Selon l'enquête OBEPI en France en 2009 : 31.9 % des adultes de plus de 18 ans sont en surpoids et 14.5% sont obèses (1).
Par rapport à la prévalence de 2006, on note une augmentation de 10.7%.
L'obésité morbide diminue l'espérance de vie de 10 à 15 ans. La mortalité et la morbidité de l'obésité morbide sont essentiellement dues à l'existence de facteurs de risques associés, multiples, surtout cardio-vasculaires (HTA, diabète type 2, syndrome des apnées du sommeil, dyslipidémies...)
- Bénéfices de la chirurgie bariatrique
Le traitement chirurgical de l'obésité morbide est désormais reconnu comme une solution efficace pour améliorer les conditions de vie de ces patients. L'effet à court et moyen termes sur les facteurs de comorbidité est maintenant bien documenté. Nous savons maintenant que les traitements médicaux comportant l'utilisation de bonnes pratiques hygiéno-diététiques, une modification des comportements alimentaires et médications symptomatiques échouent dans le cadre de ces obésités morbides.
L'objectif de la chirurgie bariatrique est de redonner une espérance de vie superposable à celle de la population "normale". Il a en effet été démontré que la perte de poids obtenue à terme entrainait une diminution de la mortalité globale et améliorait la qualité de vie.
- Types d'interventions proposées (2, 3)
- Interventions restrictives : Anneau gastrique et sleeve gastrectomy. Elles impliquent une restriction du volume de l’estomac. Le choix du type d'intervention est fonction du risque opératoire pour ces patients fragiles et de leur IMC.
- Interventions "mixtes" (restrictives et malabsorptives) : Gastric by-pass. Elles nécessitent, quant à elles, un court-circuit gastrointestinal afin de limiter l'absorption des graisses et réduire ainsi l'apport calorique.
- Indications opératoires de la chirurgie bariatrique
critères de sélection codifiés par les anglo-saxons (American Society of Bariatric Surgery Consensus)
- IMC>40 ou
- 35 > IMC > 40 avec comorbidités (HTA, diabète, etc...)
Les patients doivent également respecter les critères sous-jacents :
- 18-50 ans
- Obésité stable depuis 5 ans
- Echec des autres prises en charge au moins depuis un an
- Complications somatiques sévères
- Patients motivés et bien informés
- Absence de dépendance à l'alcool et aux drogues
- Absence de pathologie endocrinienne
- Risque opératoire acceptable
- Contre-indications opératoires
Il s'agit surtout des troubles psychiatriques, de l'alcoolisme, la toxicomanie, les maladies évolutives (néoplasie, maladie inflammatoires du tube digestif...) et des patients souffrant de troubles du comportement alimentaire.
Anneau gastrique
Généralités et description
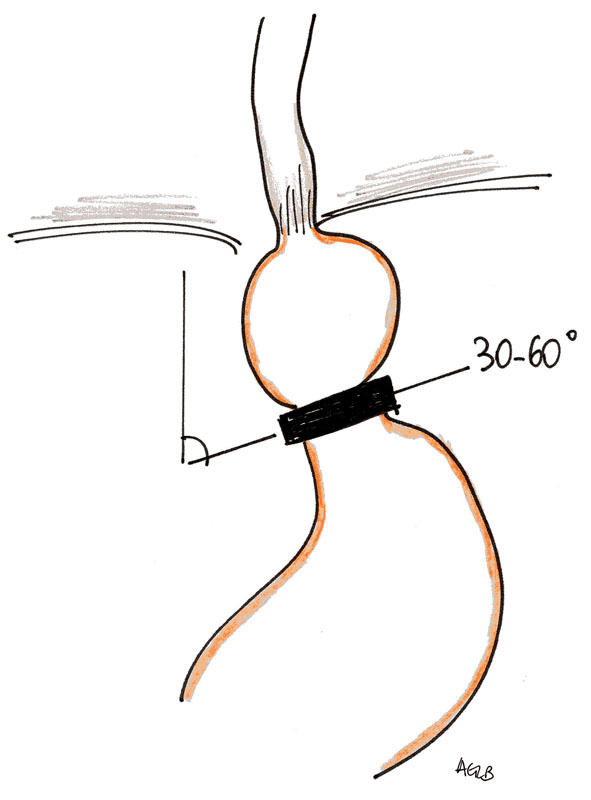
L’anneau gastrique est constitué en réalité de 3 parties : l’anneau à proprement parlé, relié par un cathéter à un boitier positionné dans les plans sous-cutanés profonds. Il s'agit toujours de dispositifs en silicone médical implantables, monoblocs, encliquetables, possédant un verrou et comportant un ballonnet gonflable interne. Ce dernier permet l'ajustage de l'anneau qui est ainsi modulable dans son diamètre grâce au boitier (silicone et titane) qui sert alors de chambre d'ajustage. L'anneau est placé à la partie supérieure de l'estomac à environ 2 cm de la jonction oesogastrique créant ainsi une petite poche ou néo-estomac.
L'anneau est placé à la partie supérieure de l'estomac à environ 2 cm de la jonction oesogastrique créant ainsi une petite poche ou néo-estomac.
Un remplissage au sérum physiologique de la chambre d'ajustage par ponction à l'aiguille de Huber va faire varier le diamètre de l'anneau, entraînant ainsi un ralentissement de la vidange de la poche gastrique sus-jacente. Hormis une exception, tous ces systèmes sont radio-opaques. Afin de limiter le risque de slippage, la paroi antérieure de l'estomac est souvent suturée à l'anneau (1).
Mécanisme d'action
Il s'agit donc d'une méthode restrictive et réversible. Ce montage chirurgical correspond à une gastroplastie horizontale. La prise alimentaire est restreinte, la vidange du petit estomac se fait lentement par le diamètre limité de la bouche gastrique ainsi créée par l'annuloplastie. L'effet restrictif est prolongé quelques heures après le repas. La sensation de satiété est également obtenue pour un moindre remplissage gastrique, du fait de la stimulation des récepteurs de la paroi gastrique transmise à l'hypothalamus par le système parasympathique. Au phénomène restrictif purement mécanique, s'associent donc des facteurs neurophysiologiques plus complexes.
Imagerie normale (2)
L'anneau gastrique est exploré essentiellement par radiographie standard et par transit oeso-gastro-duodénal. Des clichés de face et profil stricts sans préparation sont indispensables pour s'assurer du bon positionnement de l'anneau. Il doit être orienté vers le bas, l'avant et la droite. Un angle de 30-60 degrés est décrit entre l'orientation de l'anneau et le rachis. L'anneau est circulaire sur le cliché de profil. La néopoche gastrique doit avoir un volume de 15-20 ml. Le diamètre de l'annuloplastie doit être de 3-4 mm.
L'exploration en imagerie post-opératoire n'est pas systématique puisque les complications sont rares (1).
Au scanner, on individualise le boitier en sous cutané, l'anneau gastrique en lui même et le cathéter reliant les deux.
Complications aigues et imagerie (3, 4, 5)
Les complications précoces sont avant tout les complications générales liées directement à l'obésité. Les autres complications sont plus rares.
La mortalité est de l'ordre de 0.1%, la morbidité de 5% (6).
- Complications d'ordre général et liées au terrain : embolie pulmonaire, phlébite, infection pulmonaire, hypoxie et ischémie cérébrale.
- Perforation gastrique:
Perforation gastrique : fistule digestive et collection +/- abcédée. La perforation gastrique apparaît le plus souvent tardivement. (7)
La fuite de produit de contraste extra digestive peut être visible au transit oesophagien. Le scanner, plus sensible peut également mettre en évidence une fuite plus discrète passée inaperçue au TOGD.
-
Dysfonctionnement de l’anneau (4-13%) :- Glissement ou bascule ou "slippage"- Glissement postérieur (82%), dilatation inféro-postérieure de la néopoche, verticalisation de l'anneau qui a tourné dans le sens anti-horaire.- Glissement antérieur (18%), l'anneau s'horizontalise, dans le sens horaire, dilatation antérieure et supérieure.Il existe alors un niveau liquide-air dans la néopoche qui est augmentée de taille, avec un surplomb, ainsi qu'un ralentissement ou une absence de passage de produit de contraste au travers de l'anneau.Un desserrage de l'anneau par ponction du boitier est nécessaire. Si cela n'améliore pas le patient, il faut suspecter une strangulation, c'est-à-dire un véritable volvulus de la néopoche gastrique (6) avec risque de nécrose gastrique.
-
Malposition de l'anneau (2.3%), souvent due à un manque d'expérience du chirurgien, l'anneau est alors placé trop bas.
Sleeve gastrectomy
Technique chirurgicale (1)
C'est une technique relativement récente dont les premières publications datent de 2005. Elle est proposée en première intention aux patients souffrant d'obésité majeure ou à haut risque opératoire. Parfois, elle constitue le premier temps opératoire avant d'être completée par une dérivation digestive type gastric by-pass. Ce geste de gastrectomie est relativement simple comparativement aux autres techniques comme le gastric by-pass. Elle est dotée d'un faible taux de morbidité et de mortalité. (2, 3, 4)
La Sleeve gastrectomy est considérée comme une technique sure pour les patients à haut risque opératoire. Dans une étude récente de 2006, les patients obèses et super-obèses obtenaient à court terme une perte de poids satisfaisante avec de faibles complications et une mortalité nulle (4).
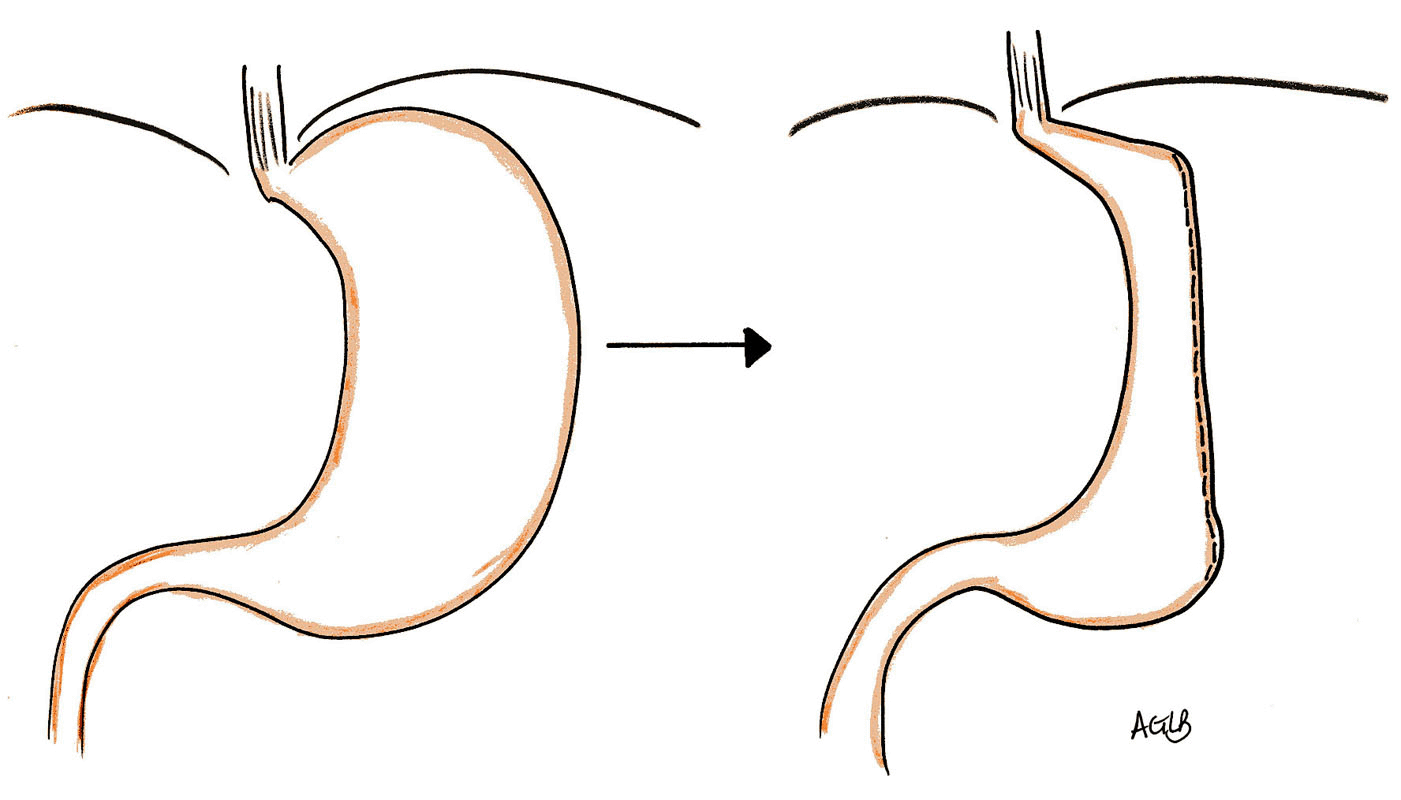
Elle consiste en une gastrectomie verticale, en gouttière, tubulaire, de plus des deux tiers de l'estomac le long de la petite courbure gastrique, emportant toute la grande courbure. Elle est réalisée sous coelioscopie après calibrage, par sonde, de l'estomac. Le chirurgien repère le pylore et positionne un lacq 8 cm en amont du pylore. Ensuite, il réalise la gastrectomie à proprement parler en coupant l'estomac après l'avoir tubulisé avec un tube de Faucher (calibre : 30 French). Le volume restant de l'estomac doit être d'environ 100 ml.
Son efficacité est, d'une part, due au phénomène restrictif pur (restriction du volume gastrique) et d'autre part, à la résection des cellules pariétales fundiques sécrétrices de ghréline (5, 6) . Cette hormone stimule l'appêtit par le biais de l'axe hypothalamo-hypophysaire.
Cette intervention est dotée d'une faible mortalité (0 à 3.2%), le taux de complications varie selon les séries (0 à 12.9 %). (7, 8, 9)
La perte de poids après sleeve gastrectomy varie selon les études ( entre 33 et 83%).
Elle peut être proposée après un échec de l'anneau gastrique (10)
Imagerie post-opératoire (11)
Il n'y a pas de consensus concernant la réalisation des opacifications digestives en période post-opératoire des chirurgies bariatriques. Certains auteurs préconisent sa réalisation systématique tandis que d'autres ont une approche beaucoup plus sélective. Goitein rapporte dans une étude récente de 2009 l'intérêt de réaliser un transit aux hydrosolubles de façon systématique à J1 post-opératoire (12). D'une part, cela permet d'éliminer les complications post-opératoires comme les fistules ou les sténoses sur la ligne d'agrafage. D'autre part, cette méthode simple et sure apporte des informations sur la nouvelle anatomie de la gouttière gastrique. Enfin, elle renseigne sur la tolérance de la reprise alimentaire et permettrait de réalimenter les patients et les faire sortir plus rapidement en cas de normalité.
Le scanner n'est pas systématique, il doit être réservé aux complications post opératoires cliniques et ou en complément d'un TOGD douteux. Le balisage digestif haut aux hydrosolubles permet de mieux individualiser la lumière gastrique restante et de rechercher une éventuelle fistule gastrique.
La ligne d'agrafage est bien visible, il ne doit pas y avoir de collection ni d'infiltration importante au contact de la ligne d'agrafage.
Complications aigues et imagerie (13)
Une étude de 2011 relevait un taux de complications de 12.9%. Les complications post-opératoires les plus fréquentes sont la fistule sur ligne d'agrafage (3.5%), une hémorragie sur ligne d'agrafage (3.5%), une sténose de l'agrafage (2.3%),une embolie pulmonaire (1.2%) et une hernie sur orifice de trocart (1.2%) (9).
- Fistules
- Hémorragie et hématome le long de la suture gastrique
- Sténose de la partie basse du tube gastrique
Du fait d'un agrafage imparfait non parallèle à la petite courbure gastrique (gastrectomie en biais) : cet aspect est mieux analysable au TOGD.
Gastric by-pass
Généralités
Il s'agit d'un court circuit gastrique, devenu actuellement le traitement chirurgical de référence du traitement chirurgical de l'obésité morbide pour de nombreux auteurs. Le gastric by-pass est considéré comme l'intervention chirurgicale la plus efficace avec une perte de poids de 70% en un an. Cette procédure est plus complexe que les simples interventions de restriction gastrique "pures". Les premières réalisations en France sous laparoscopie ont eu lieu en 1996.
La mortalité post-opératoire est de 0.35-0.5%, l'embolie pulmonaire est la première cause de décès post-opératoire.La morbidité est de 16.8% (1)
Indications du gastric by pass
En 1ère intention
- >40 ans
- superobèses (IMC>50)
- diabète type 2
- pathologies avec absence de sensation de satiété (craniopharyngiome, syndrome de Prader-Willy)
Principe et Physiologie : COURT CIRCUIT ALIMENTAIRE
Efficacité du by-pass versus technique restrictive pure :
- Perte de poids plus rapide et plus importante (dans une étude de 2008 portant sur 1518 patients, comparant le by-pass gastrique et l'anneau gastrique) (2)
- Restriction alimentaire (néopoche gastrique)
- Malabsorption (dont le degré dépend de la longueur de l’anse en Y)
- Dumping syndrome qui entraîne un dégoût pour les aliments sucrés
- Anorexie liée à la baisse de sécrétion de ghréline par l’estomac
Ce montage permet une malabsorption des graisses essentiellement puisqu'elles doivent être absorbée en association avec les sels biliaires. La malabsorption protéique est moindre car les protéines sont également absorbées par la salive, les sucs intestinaux tout le long de l’anse digestive. Les glucides peuvent être absorbés le long de l’anse alimentaire. Il a été démontré que le diabète de type 2 est amélioré nettement après un gastric by-pass bien avant souvent la perte de poids. Ceci par deux mécanismes : D'une part du fait de la perte de poids et d’autre part du fait d’une diminution de l’insulino-résistance.
Montage chirurgical et imagerie normale
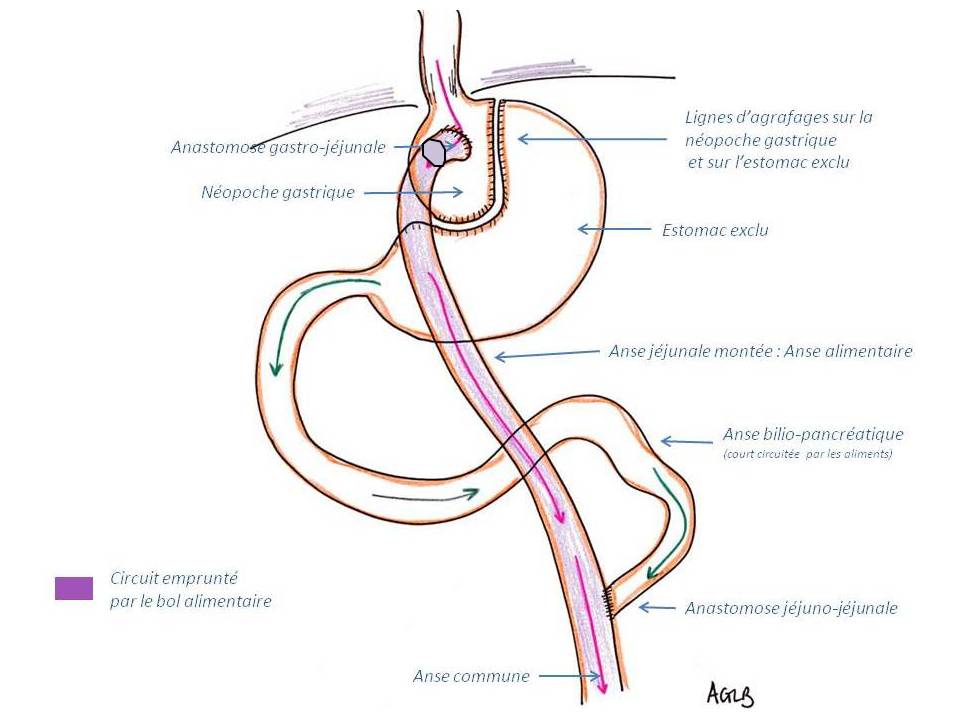
La poche gastrique est visible en suivant l’œsophage. Elle doit être de petit volume (20-30 ml) pour assurer une satiété rapide, diminuer la prise alimentaire et limiter le risque d’ulcère anastomotique. Elle doit être créée le long de la petite courbure et orientée verticalement. Le diamètre de l’orifice de vidange doit être calibré autour de 12 mm. La poche gastrique va progressivement s'hyperplasier par dérivation de sa fonction normale. Une stabilisation de la dilatation de la poche gastrique survient en général au cours de la 2ème année (90-300 ml). Il est nécessaire de réaliser une partition gastrique par transsection et séparation complète entre la poche proximale et le reste de l’estomac afin d’éviter les échecs par reperméabilisation de la ligne d’agrafage.
L’estomac exclu doit être de petit volume ou être complétement collabé, contenant air ou liquide. Il ne doit pas exister de produit de contraste oral au sein de cet estomac exclu ni dans le duodénum. Parfois, un minime reflux de produit de contraste hydrosoluble oral est visible dans la portion très inférieure de l'anse bilio-pancréatique via l'anastomose au pied de l'anse.
Configuration élémentaire de l'anse en Y de Roux conçue en chirurgie bariatrique
- Comme la lettre "Y", l'anse de Roux a trois segments intestinaux confluents à un point central qui est une l'anastomose jéjuno-jéjunale.
- L'un des segments correspond à l'anse bilio-pancréatique, c'est l'anse afférente constituant le segment "by-passé" où la nourriture n'entre pas en contact avec la muqueuse digestive. Cette anse transporte la majorité des sucs digestifs, elle n'est pas "exclue" car constamment lavée par les sécrétions gastriques et bilio-pancréatiques. Elle mesure 75 cm depuis l'angle de Treitz jusqu'à l'anastomose jéjuno-jéjunale.
- Complications d'ordre général
- Complications pariétales : Hématome, abcès de paroi...sont très fréquents chez les patients obèses
- Fistules anastomotiques ou sur tranches de section
- L'anse commune met alors en contact les aliments provenant de l'anse efférente et les sels biliaires et les sucs digestifs provenant de l'anse afférente.
- L'anastomose gastro-jéjunale est termino-latérale le plus souvent. Elle peut être manuelle ou mécanique (circulaires ou linéaires).
- L'anastomose jéjuno-jéjunale (au pied de l'anse) est faite latéralement (anastomose latéro-latérale ou termino-latérale). Elle peut également être mécanique ou manuelle mais cela est plus difficile et rallonge la durée de l'intervention.
- Après balisage digestif haut aux hydrosolubles, l'anse efférente (alimentaire) est opacifiée. Les hydrosolubles n'opacifient pas l'anse afférente (court-circuitée).
Le duodénum et le segment jéjunal de l’anse pancréato-biliaire ont un diamètre <2.5 cm.
- Selon Yu (1), la néopoche gastrique est visible au scanner dans 96%, l'estomac exclu dans 100%, l'anse efférente proximale dans 99%, l'anse jéjunale montée dans 88% et l'anastomose jéjunale (au pied de l'anse) dans 87%.
Place de l'imagerie post-opératoire
Kolakowski et al. ont montré que la réalisation systématique d'opacification digestive haute en post-opératoire précoce n'est pas informative : La présence de signes cliniques comme la fièvre, tachycardie, nausée, vomissement, sont des arguments prédictifs de complications et que de ce fait l'examen d'opacification est superflu (3). Cependant, selon les équipes, un Transit oesophagien est souvent réalisé entre J1 et J4 avant réalimentation pour explorer l'anastomose gastro-jéjunale ; c'est l'attitude adoptée par l'équipe tourangelle.
Pareillement, Dallal et al. ont montré que l'exploration par Transit oesophagien (TO) non systématique mais sélective et fonction du tableau clinique du patient n'était pas délétère dans la surveillance et l'évolution post-opératoire (4).
Le scanner n'est réalisé qu'en cas de complications ou lorsque le TO n'est pas contributif (élément limitant : obésité réduisant la qualité des images)
Complications et imagerie (5)
- La littérature rapporte 20 à 25 % de complications.
Selon l'équipe de Chandler (6), la complication post-opératoire précoce la plus fréquente est la fistule anastomotique de l’anastomose gastro-jéjunale (2-5 %).
- La mortalité post-opératoire est de 0.35-0.5 %, l'embolie pulmonaire étant la première cause.
Yu (1) rapporte les complications suivantes identifiées sur le scanner post-opératoire : Collection liquidienne suspecte de fistule (12%), une fuite extradigestive (16%), distension marquée de l'estomac exclu (8%), un infarctus splénique (7%), un hématome (7%), un infarctus du lobe gauche hépatique (4%), une hernie interne post opératoire (14%) et une occlusion des anses grêles (8%)
- Embolie pulmonaire : Première cause de mortalité
- Pneumopathie, atélectasie, détresse respiratoire, etc...
-
Elles peuvent siéger en 4 sites :
- Complications hémorragiques
- Anastomose gastro-jéjunale (70%),
- Estomac distal exclu (au niveau de la ligne d'agrafage)(9%),
- Anastomose jéjuno-jéjunale (15%)
- Néopoche gastrique (6%).
Il s'agit essentiellement de fistule de l'anastomose gastro-jéjunale (6, 7, 8) : Souvent secondaire à une ischémie sur le versant gastrique de l'anastomose par lésion des vaisseaux gastriques au cours de la mobilisation ou par distension de l'estomac au cours des premières heures post-opératoires.
La fistule gastro-gastrique est due soit à un défaut de section chirurgicale entre les deux portions gastriques (persistance d'un pont entre l'estomac exclu et la néopoche gastrique) soit à l'érosion des deux sutures gastriques suite à un abcès. Elle se traduit par la présence de produit de contraste oral dans l'estomac exclu en quantité anormalement importante ou alors qu'il n'y en a pas du tout dans l'anse bilio-digestive.
Les hémorragies digestives peuvent survenir sur les mêmes sites de prédilection que les fistules digestives. Cliniquement, il peut y avoir une hématémèse (anastomose gastro-jéjunale ou poche gastrique) un mélaena ou une rectorragie (estomac exclu ou jéjunojéjunostomie). Le site de prédilection est la ligne d'agrafage gastrique.
Le scanner met en évidence une hyperdensité spontanée dans la lumière digestive. En cas de fistule associée, l'hyperdensité peut être visible dans la cavité péritonéale. Si le scanner est réalisé en période hémorragique, l'extravasation de produit de contraste iodé en regard de l'anastomose peut être détecté.
- Occlusion précoce
Le plus souvent, il s'agit d'une sténose de l’anastomose jéjuno-jéjunale : Le scanner montre donc une distension de la néopoche gastrique, de l'estomac exclu, de l'anse jéjunale montée et de l'anse bilio-digestive jusqu'à l'anastomose jéjuno-jéjunale. Le jéjunum distal, en aval de l'anastomose est plat.
Moins souvent, il survient une torsion de l’anse bilio-pancréatique en amont de l’anastomose, responsable d’une dilatation de l'estomac exclu.
Une occlusion par incarcération d'anses est possible.
Une occlusion de l'anastomose gastro-jéjunale est souvent due à un oedème anastomotique qui régresse généralement en une à deux semaines.
Les hernies internes sont assez fréquentes chez cette population (9). (3.1%). Il existe 3 orifices particuliers. Le plus fréquent (2.2%), est la hernie au travers de l'orifice du mésocolon (qui permet l'ascension à l'étage sus mésocolique de l'anse en Y de Roux). Le second est la hernie de Peterson (0.7), qui se créée dans le trou entre le mésocolon et le mésentère de l'anse grêle ascensionnée. Plus rarement, peut survenir une hernie au travers d'un orifice de mésentère (0.25%) notamment au niveau de l'anastomose jéjuno-jéjunale. Exemple : Hernie interne avec twist du pied de l'anse, occlusion de l'anse alimentaire et de l'estomac exclu et de l'anse bilio-pancréatique, l'anse commune est par contre plate.
- Ligne d'agrafage sténosant sur l'estomac exclu (10)
Un agrafage non parallèle à la grande courbure gastrique et qui a tendance à se rapprocher de cette dernière avec un aspect de convergence des plis gastriques peut être responsable d'une dilatation de la portion supérieure de l'estomac exclu qui de ce fait, se draine difficilement vers la région antro-pylorique. L'exploration radiologique repose essentiellement sur l'opacification aux hydrosolubles et l'étude dynamique sous scopie.
___
Références bibliographiques
Généralités :
(1) Obépi Roche. Enquête épidémiologique nationale sur le surpoids et l'obésité, Inserm / TNS Healthcare sofres / Roche, 2009
(2) Trenkner SW. Imaging of morbid obesity procedures and their complications. Abdom Imaging. 2009 May-Jun;34(3):335-44. Review. PubMed PMID: 18365268
(3) Kothari SN. Bariatric surgery and postoperative imaging. Surg Clin North Am. 2011 Feb;91(1):155-72. Review. PubMed PMID: 21184906.
Anneau Gastrique
(2) Carucci LR, Turner MA, Szucs RA. Adjustable laparoscopic gastric banding for morbid obesity: imaging assessment and complications. Radiol Clin North Am. 2007 Mar;45(2):261-74. Review. PubMed PMID: 17502216.
(3) Prosch H, Tscherney R, Kriwanek S, Tscholakoff D. Radiographical imaging of the normal anatomy and complications after gastric banding. Br J Radiol. 2008 Sep;81(969):753-7. Epub 2008 May 28. Review. PubMed PMID: 18508872.
(4) Mehanna MJ, Birjawi G, Moukaddam HA, Khoury G, Hussein M, Al-Kutoubi A. Complications of adjustable gastric banding, a radiological pictorial review. AJR Am J Roentgenol. 2006 Feb;186(2):522-34. Review. PubMed PMID: 16423963.
(5) Blachar A, Blank A, Gavert N, Metzer U, Fluser G, Abu-Abeid S. Laparoscopic adjustable gastric banding surgery for morbid obesity: imaging of normal anatomic features and postoperative gastrointestinal complications. AJR Am J Roentgenol. 2007 Feb;188(2):472-9. Review. PubMed PMID: 17242257.
(6) Kicska G, Levine MS, Raper SE, Williams NN. Gastric volvulus after laparoscopic adjustable gastric banding for morbid obesity. AJR Am J Roentgenol. 2007 Dec;189(6):1469-72. PubMed PMID: 18029887.
(7) Hainaux B, Agneessens E, Rubesova E, Muls V, Gaudissart Q, Moschopoulos C, Cadière GB. Intragastric band erosion after laparoscopic adjustable gastric banding for morbid obesity: imaging characteristics of an underreported complication. AJR Am J Roentgenol. 2005 Jan;184(1):109-12. PubMed PMID: 15615959
Sleeve Gastrectomy
(1) Shi X, Karmali S, Sharma AM, Birch DW. A review of laparoscopic sleeve gastrectomy for morbid obesity. Obes Surg. 2010 Aug;20(8):1171-7. Review. PubMed PMID: 20379795.
(2) Lee CM, Cirangle PT, Jossart GH. Vertical gastrectomy for morbid obesity in 216 patients: report of two-year results. Surg Endosc. 2007 Oct;21(10):1810-6. Epub 2007 Mar 14. PubMed PMID: 17356932.
(3) Regan JP, Inabnet WB, Gagner M, Pomp A. Early experience with two-stage laparoscopic Roux-en-Y gastric bypass as an alternative in the super-super obese patient. Obes Surg. 2003 Dec;13(6):861-4. PubMed PMID: 14738671.
(4) Roa PE, Kaidar-Person O, Pinto D, Cho M, Szomstein S, Rosenthal RJ. Laparoscopic sleeve gastrectomy as treatment for morbid obesity: technique and short-term outcome. Obes Surg. 2006 Oct;16(10):1323-6. PubMed PMID: 17059741.
(5) Langer FB, Reza Hoda MA, Bohdjalian A, Felberbauer FX, Zacherl J, Wenzl E, Schindler K, Luger A, Ludvik B, Prager G. Sleeve gastrectomy and gastric banding: effects on plasma ghrelin levels. Obes Surg. 2005 Aug;15(7):1024-9. PubMed PMID: 16105401.
(6) Ariyasu H, Takaya K, Tagami T, Ogawa Y, Hosoda K, Akamizu T, Suda M, Koh T, Natsui K, Toyooka S, Shirakami G, Usui T, Shimatsu A, Doi K, Hosoda H, Kojima M, Kangawa K, Nakao K. Stomach is a major source of circulating ghrelin, and feeding state determines plasma ghrelin-like immunoreactivity levels in humans. J Clin Endocrinol Metab. 2001 Oct;86(10):4753-8. PubMed PMID: 11600536.
(7) Aggarwal S, Kini SU, Herron DM. Laparoscopic sleeve gastrectomy for morbid obesity: a review. Surg Obes Relat Dis. 2007 Mar-Apr;3(2):189-94. Review. PubMed PMID: 17386400.
(8) Catheline JM, Cohen R, Khochtali I, Bihan H, Reach G, Benamouzig R, Benichou J. Treatment of super super morbid obesity by sleeve gastrectomy. Presse Med. 2006 Mar;35(3 Pt 1):383-7. French. PubMed PMID: 16550126.
(9) Triantafyllidis G, Lazoura O, Sioka E, Tzovaras G, Antoniou A, Vassiou K, Zacharoulis D. Anatomy and complications following laparoscopic sleeve gastrectomy: radiological evaluation and imaging pitfalls. Obes Surg. 2011 Apr;21(4):473-8. PubMed PMID: 20652760.
(10) Acholonu E, McBean E, Court I, Bellorin O, Szomstein S, Rosenthal RJ. Safety and short-term outcomes of laparoscopic sleeve gastrectomy as a revisional approach for failed laparoscopic adjustable gastric banding in the treatment of morbid obesity. Obes Surg. 2009 Dec;19(12):1612-6. Epub . PubMed PMID: 19711138.
(11) Werquin C, Caudron J, Mezghani J, Leblanc-Louvry I, Scotté M, Dacher JN, Savoye-Collet C. Early imaging features after sleeve gastrectomy. J Radiol. 2008 Nov;89(11 Pt 1):1721-8. French. PubMed PMID: 19106828.
(12) Goitein D, Goitein O, Feigin A, Zippel D, Papa M. Sleeve gastrectomy: radiologic patterns after surgery. Surg Endosc. 2009 Jul;23(7):1559-63. Epub 2009 Feb 27. PubMed PMID: 19247709.
(13) Frezza EE, Reddy S, Gee LL, Wachtel MS. Complications after sleeve gastrectomy for morbid obesity. Obes Surg. 2009 Jun;19(6):684-7. Epub 2008 Oct 16. PubMed PMID: 18923879.
Gastric By-pass
(1) Yu J, Turner MA, Cho SR, Fulcher AS, DeMaria EJ, Kellum JM, Sugerman HJ. Normal anatomy and complications after gastric bypass surgery: helical CT findings. Radiology. 2004 Jun;231(3):753-60. PubMed PMID: 15163816
(2) Puzziferri N, Nakonezny PA, Livingston EH, Carmody TJ, Provost DA, Rush AJ. Variations of weight loss following gastric bypass and gastric band. Ann Surg. 2008 Aug;248(2):233-42. PubMed PMID: 18650633.
(3) Kolakowski S Jr, Kirkland ML, Schuricht AL. Routine postoperative upper gastrointestinal series after Roux-en-Y gastric bypass: determination of whether it is necessary. Arch Surg. 2007 Oct;142(10):930-4; discussion 934. PubMed PMID: 17938304.
(4) Dallal RM, Bailey L, Nahmias N. Back to basics--clinical diagnosis in bariatric surgery. Routine drains and upper GI series are unnecessary. Surg Endosc. 2007 Dec;21(12):2268-71. Epub 2007 May 5. PubMed PMID: 17483995.
(5) Andrés M, Pérez M, Roldán J, Borruel S, de la Cruz Vigo J, Azpeitia J, Alvarez E, Carrera R, Muñoz V. Roux-en-Y gastric bypass: major complications. Abdom Imaging. 2007 Sep-Oct;32(5):613-8. PubMed PMID: 17874266.
(6) Chandler RC, Srinivas G, Chintapalli KN, Schwesinger WH, Prasad SR. Imaging in bariatric surgery: a guide to postsurgical anatomy and common complications. AJR Am J Roentgenol. 2008 Jan;190(1):122-35. Review. PubMed PMID: 18094302.
(7) Papasavas PK, Caushaj PF, McCormick JT, Quinlin RF, Hayetian FD, Maurer J, Kelly JJ, Gagné DJ. Laparoscopic management of complications following laparoscopic Roux-en-Y gastric bypass for morbid obesity. Surg Endosc. 2003 Apr;17(4):610-4. Epub 2003 Feb 17. PubMed PMID: 12582772.
(8) Blachar A, Federle MP. Gastrointestinal complications of laparoscopic roux-en-Y gastric bypass surgery in patients who are morbidly obese: findings on radiography and CT. AJR Am J Roentgenol. 2002 Dec;179(6):1437-42. PubMed PMID: 12438032.
(9) Patel RY, Baer JW, Texeira J, Frager D, Cooke K. Internal hernia complications of gastric bypass surgery in the acute setting: spectrum of imaging findings. Emerg Radiol. 2009 Jul;16(4):283-9. Epub 2008 Dec 17. Review. PubMed PMID: 19089479.
(10) Carucci LR, Turner MA, Yu J. Imaging evaluation following Roux-en-Y gastric bypass surgery for morbid obesity. Radiol Clin North Am. 2007 Mar;45(2):247-60. Review. PubMed PMID: 17502215.
| < Précédent | Suivant > |
|---|





