PANCREATITE AIGUE :
La pancréatite aiguë (PA) est une affection inflammatoire aiguë du pancréas. Il s’agit d’une pathologie fréquente qui représente entre 0,15 et 1,5% des admissions dans les services d’urgences(1).
Les deux principales étiologies sont l’intoxication alcoolique (50%) et l’origine biliaire (lithiase de la VBP, 30%). Les autres causes sont plus rares. Une cause particulière est représentée par une pancréatite en amont d’une tumeur obstruant le canal de Wirsung(2). Dans 10% des cas, aucune cause n’est retrouvée au terme du bilan (PA idiopathique).
Le diagnostic positif est posé devant l’association d’une douleur abdominale compatible et d’une élévation de la lipasémie à plus de 3 fois la normale.
On distingue 2 formes de PA d’évolution différente(3): la PA oedémateuse (80%) est une forme de gravité atténuée et d’évolution favorable, au contraire de la PA nécrotique et hémorragique (20%) qui s’accompagne de coulées de nécrose extra-pancréatiques avec défaillance uni ou multi-viscérale, et dont la mortalité varie entre 2 et 10%(4). De nombreux scores cliniques et biologiques permettent l’établissement d’un pronostic.
L’imagerie, représentée essentiellement par la tomodensitométrie, est omniprésente dans les différentes étapes de la prise en charge de ces patients, pour orienter vers le diagnostic positif et étiologique, mais surtout pour établir un diagnostic de gravité, rechercher des complications et guider les traitements.
Imagerie diagnostique :
Radiologie standard :
Le cliché d’ASP ne doit plus être pratiqué dans le bilan d’une PA. Souvent normal, il peut montrer une anse grêle sentinelle (anse satellite remplie d’air et/ou iléus duodénal) ou un iléus réflexe plus diffus(2). Son seul intérêt dans un contexte de syndrome douloureux abdominal aigü est d’éliminer un pneumopéritoine, une perforation digestive pouvant simuler un tableau de PA.
Une radiographie thoracique de face pourra rechercher un épanchement pleural, siègeant préférentiellement à gauche, et servira de référence en cas d’installation ultérieure d’une défaillance respiratoire.
Echographie :
Peu utile pour le diagnostic, sa réalisation est en plus rendue difficile par l’iléus. Son intérêt réside plus dans le bilan étiologique pour rechercher des lithiases vésiculaires et/ou cholédociennes, orientant alors vers une origine biliaire .
Tomodensitométrie :
Le scanner est la technique d’imagerie de référence en cas de PA. Le diagnostic de PA étant clinico-biologique, l’indication du TDM à visée diagnostique concerne les situations cliniques difficiles, les patients vus tardivement (enzymes pancréatiques renormalisées), ou les patients dont l’état s’aggrave en post-opératoire sans raison apparente(5).
Alors que son intérêt diagnostique pour les PA bénignes est minime, il permet pour les PA plus sévères d’obtenir un pronostic et de rechercher des complications. A ce titre il ne doit pas être réalisé trop précocément pour ne pas sous-estimer les lésions, celles-ci n’étant totalement constituées qu’au bout de 48h d’évolution(6).
Une 1ère hélice sans injection de contraste est nécessaire pour rechercher des calculs dans les voies biliaires et pour rechercher des collections hématiques spontanément hyperdenses. En l’absence de contre-indication, on réalisera une acquisition abdominopelvienne avec injection de produit de contraste iodé en 2 temps (artériel pancréatique et portal), afin d’apprécier au mieux l’étendue de la nécrose et de rechercher des complications.
Les 2 formes anatomopathologiques présentent des aspects TDM différents(2; 5; 7) :
- En cas de PA oedémateuse bénigne :
- l’examen TDM peut être normal, ce qui n’exclut pas pour autant le diagnostic qui reste clinico-biologique.
- la glande peut être le siège d’un œdème localisé ou diffus, et apparaître globalement ou focalement hypertrophiée avec perte de sa lobulation physiologique et aspect flou de ses contours. Le diamètre antéro-postérieur de la tête pancréatique ne doit pas dépasser le diamètre transverse du corps vertébral adjacent.
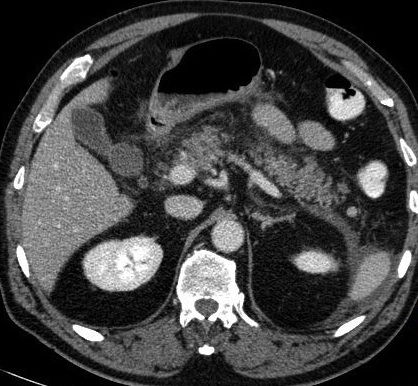
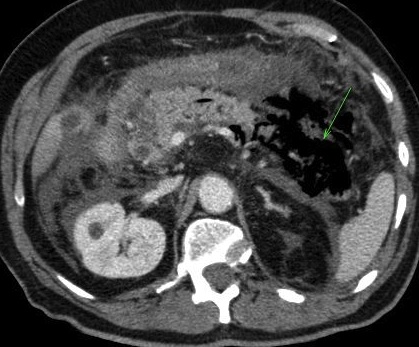
- l’œdème peut s’étendre au delà du pancréas, ce qui se traduit par une densification de la graisse péri-pancréatique (image1, image2), parfois associée à un épaississement des fascias pararénaux. La graisse de la région coeliaque, entourant l’origine du tronc coeliaque et de l’artère mésentérique supérieure est habituellement respectée. Son atteinte doit faire suspecter un processus tumoral sous jacent de type adénocarcinome.
- Les PA nécrotiques et hémorragiques se distinguent par la présence de foyers de nécrose glandulaire et de collections pancréatiques et/ou extra-pancréatiques. Ces collections sont composées de nécrose, d’hémorragie et d’exsudats.
- la nécrose se définit par une absence de réhaussement ou un défaut de réhaussement inférieur à 50 UH après injection intraveineuse de produit de contraste
- les coulées de nécrose sont spontanément de densité liquidienne remaniée, généralement comprise entre 20 et 40 UH, mais il peut exister un gradient de densité voire un niveau liquide/liquide (contingent déclive plus dense que le contingent plus superficiel) si elles sont constituées majoritairement de sang frais
- elles se traduisent par une infiltration et/ou des collections liquidiennes des fascias péritonéaux
- des ganglions réactionnels péripancréatiques sont souvent présents
- elles intéressent le plus souvent la loge péri-pancréatique, les fascias pararénaux antérieurs droit et gauche, l’arrière cavité des épiploons, le petit épiploon, le mésentère et les ligaments gastrosplénique et gastrocolique
- elles peuvent se prologer vers le pelvis, le médiastin, la plèvre ou la paroi abdominale réalisant des ecchymoses péri-ombilicales (signe de Cullen) ou des flancs (signe de Grey Turner)(8)(9)
- l’infiltration peut parfois prendre un aspect tissulaire pseudo-nodulaire, simulant des lésions de carcinose péritonéale (« étoupe pancréatique»)
- des bulles de gaz peuvent être retrouvées au sein de la nécrose ou des coulées de nécrose: elles témoignent d’une dégradation de la nécrose tissulaire, de la production de gaz par des bactéries dans le cas d’une surinfection ou de la présence de fistules avec migration de gaz digestif
- les coulées de nécrose ne sont drainées que lorsqu’elles sont surinfectées. En l’absence de bulle d’air, on peut recourir à la ponction des coulées sous TDM à visée diagnostique.
- on recherchera particulièrement dans ces formes un épanchement ascitique, le plus souvent réactionnel ou pouvant parfois correspondre à une ascite pancréatique (cf), et des épanchements pleuraux, plus fréquents à gauche
- La pancréatite aiguë emphysémateuse est une forme rare et de mauvais pronostic de PA, survenant sur un terrain débilité chez des patients diabétiques, immunodéprimés ou insuffisants rénaux. Elles associent une destruction parenchymateuse avec une infiltration aérique diffuse du pancréas et des espaces péri-pancréatiques(10).
IRM :
L’IRM n’a aujourd’hui pas de place dans le bilan diagnostic de la PA et trouve son intérêt dans le bilan étiologique dans certaines situations particulières.
Elle montre l’oedéme glandulaire en cas de PA bénigne, apparaissant en hyposignal T1 FatSat et en discret hypersignal T2 comparativement au foie et au parenchyme pancréatique sain. L’infiltration de la graisse péripancréatique est visible en hypersignal sur les séquences avec annulation du signal de la graisse. Dans les PA nécrotico-hémorragiques, l’IRM identifie les foyers de nécrose et les collections. La nécrose glandulaire se présente sous la forme de plages non réhaussées sur les séquences T1 après injection intraveineuse de gadolinium. Les collections intra ou péripancréatiques apparaissent en franc hypersignal T2, en hyposignal T1 en cas de contenu liquidien non hémorragique, et en hypersignal T1 si elles contiennent du sang frais(5).
Diagnostics différentiels
Un ulcère duodénal perforé peut s’accompagner d’une infiltration de la graisse péripancréatique. La mise en évidence d’air extradigestif permettra d’évoquer le diagnostic.
Un adénocarcinome pancréatique(cf) ou un lymphome(cf) peuvent mimer une atteinte inflammatoire glandulaire diffuse ou focale.
Diagnostic étiologique :
Les étiologies reconnues des PA sont repertoriées dans l’annexe 1.
- En cas d’étiologie biliaire,
- l’imagerie recherche des calculs vésiculaires ou dans la VBP à l’échographie et à la. Associés à un ictère ou à un score clinique et biologique de Blamey > 2, ils orientent fortement vers l’origine bilaire de la pancréatite.
- une échographie vésiculaire normale n’exclut cependant pas l’origine bilaire d’une PA(11).
- la détection d’un calcul au sein de la VBP est nettement plus intéressante. Toutefois la sensibilité de détection des calculs intra-cholédociens est médiocre, tant à l’échographie qu’au TDM(12).
- les calculs purement cholestéroliques ont une densité proche de celle de la bile au scanner et passent souvent inaperçus. Leur mise en évidence peut être facilitée par l'existence d'une zone centrale de densité graisseuse.
- la présence d’un réhaussement péricholédocien (signe de l’anneau) est un signe peu sensible mais spécifique, et traduirait une inflammation locale réactionelle en rapport avec une migration lithiasique récente(13).
- si la vacuité de la VBP ne peut être affirmée de façon formelle par l’échographie ou le scanner, la réalisation d’une écho-endoscopie ou d’une cholangiopancréato-IRM est alors indiquée (à distance de la phase aiguë en cas d’épisode grave). Leur performance diagnostique dans la détection de calcul dans la VBP est en effet très élevée, voisine de 95%(14; 15).
- en wirsungo-IRM, la lumière de la papille majeure peut ne pas être visualisée en cas de contraction physiologique du sphincter, entraînant des faux positifs par fausses images de calculs . La répétition de coupes épaisses SS FSE T2 à TE long centrées sur cette région est dans ce cas indispensable pour prouver la vacuité de la papille(15).
- l’imagerie recherche une dilatation de la voie biliaire principale et/ou des voies biliaires intrahépatiques en amont de l’obstacle lithiasique
- En cas d’étiologie alcoolique, l’imagerie recherchera des signes de pancréatite chronique (cf), une stéatose hépatique, une dysmorphie hépatique ou des signes d’hypertension portale.
- Un pancréas divisum pourra être suspecté en TDM lorsque le canal pancréatique principal se draine dans la papille mineure, mais ce diagnostic sera confirmé par la cholangiopancréato-IRM.
- Les lésions tumorales ou pseudo-tumorales pourront être appréciées en TDM ou en IRM. Elles sont suspectées devant une lésion nodulaire intrapancréatique, bien que celle ci puisse parfois correspondre à un défaut focal de réhaussement lié à la PA. Seul un contrôle tomodensitométrique ou IRM à distance de l’épisode aigü pourra faire la différence et poser l’indication d’une échoendoscopie avec biopsies orientées.
En pratique, la TDM est réalisée quasi systématiquement dans le cadre du bilan initial et pronostique de toute PA à au moins 48 heures du début de la symptomatologie douloureuse.
L’échographie est indiquée à la recherche d’une pathologie lithiasique vésiculaire.
L’IRM est indiquée en complément si le bilan étiologique est négatif, ou en cas de suspicion de pancréatite bilaire pour identifier et localiser le calcul avant sphinctérotomie endoscopique.
Diagnostic de gravité :
Il repose sur l’analyse du parenchyme pancréatique et de l’atmosphère péri-pancréatique et utilise la classification tomodensitométrique de Balthazar, décrite initialement en 1985(16) et reprise en 1990(6). Le scanner doit être réalisé au mieux 48 heures après le début de la symptomatologie afin de ne pas entraîner une sous-estimation lésionnelle. La prise en compte de la nécrose en plus du grading initial a permis la création d’un index de sévérite TDM (CTSI).
Score tomodensitométrique de gravité de Balthazar:
|
Score de Balthazar :
Grade A : pancréas normal 0 point Grade B : élargissement du pancréas 1 point Grade C : pancréas hétérogène avec densification de la graisse péripancréatique 2 points Grade D : coulée péri-pancréatique unique 3 points Grade E : coulées de nécrose multiples ou présence de bulles gazeuses au sein d'une coulée 4 points
|
|
Pourcentage de nécrose :
Pas de nécrose : 0 point Nécrose inférieure à 30 % du volume : 2 points Nécrose entre 30 et 50 % du volume : 4 points Nécrose supérieure à 50 % du volume : 6 points |
|
Score tomodensitométrique de gravité (CT severity index): addition des deux précédents
I 0 à 3 : mortalité 3 % II 4 à 6 : mortalité 6 % III 7 à 10 : mortalité 17 % |
Diagnostic et traitement des complications :
Les différentes complications de la PA sont résumées dans l’annexe 2.
Complications vasculaires(4; 5) :
Thromboses veineuses :
Elles surviennent au cours des pancréatites nécrotico-hémorragiques qui peuvent entraîner des thromboses au contact des zones de nécrose. La thrombose de la veine splénique est la plus fréquente mais la veine mésentérique supérieure et la veine porte sont aussi concernées. Au scanner, le thrombus apparaît spontanément hyperdense sur la série sans injection. Après injection, la thrombose se traduit par un défect de remplissage central, cerné par du produit de contraste, et souvent associé à une augmentation du calibre veineux dans les thromboses récentes. En cas d’obstruction veineuse splénique, il se développe rapidement un réseau de circulation veineuse collatérale périgastrique (veines gastriques courtes, gastro-épiploïques, tronc gastro-colique de Henlé) avec risque d’hémorragie digestive par hypertension portale segmentaire. Une thrombose porte complète peut entraîner la formation d’un cavernome prenant à l’imagerie l’aspect d’un réseau veineux variqueux siègeant en lieu et place du tronc porte.
Faux anévrismes (ou pseudo-anévrismes) :
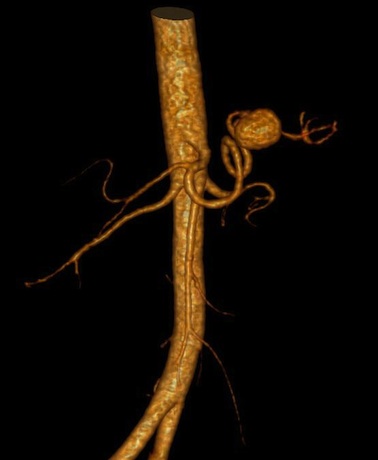
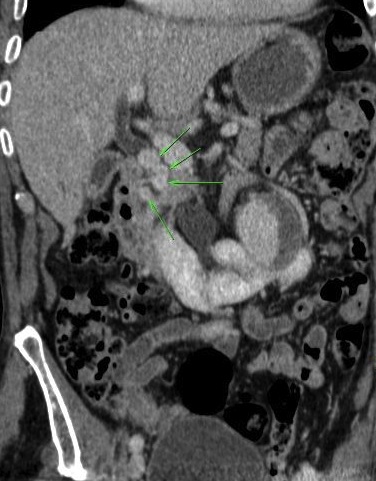
Il s’agit de la dilatation localisée d’une artère splanchnique due à l’autodigestion et à l’érosion d’une paroi vasculaire par les enzymes pancréatiques. Ils sont développés essentiellement aux dépens des artères gastro-duodénales et splénique et sont généralement associés à un pseudo-kyste. Ils peuvent apparaître à tout moment de l’évolution du processus inflammatoire et évoluent inéluctablement vers la rupture. Ils doivent donc être systématiquement recherchés dans le bilan de toute PA, sous la forme de formations nodulaires isodenses à l’aorte au temps artériel de l’injection. Leur mise en évidence peut être facilitée par les reformations MIP (Maximum Intensity Projection) multiplanaires, curvilignes selon le trajet du vaisseau et les reconstructions volumiques en rendu de volume.
La rupture du faux anévrisme peut se faire dans le pseudo-kyste, dans la cavité péritonéale ou dans le canal pancréatique principal et être extériorisée par la papille duodénale majeure (wirsungorragies) en cas de pseudo-kyste communicant (Hemosuccus pancreaticus). Ils sont traités par embolisation ou par chirurgie, permettant de réduire à 10% le taux de mortalité associé.
En dehors de la rupture de faux anévrismes, les PA nécrosantes peuvent entraîner des hémorragies par plaies capillaires ou veineuses. Le scanner montre alors une collection spontanément dense (densité>50UH), parfois au sein d’un pseudokyste connu, et recherche un saignement actif visible sous la forme d’une extravasation de produit de contraste avec blush au temps artériel angiographique de l’injection(2).
Collections liquidiennes(4; 5) :
Pseudo-kyste :
Il apparaît plus de 4 semaines après le début de la PA et correspond à une collection de suc pancréatique non résorbée ou alimentée par une fistule avec le canal pancréatique principal. Ils se développent dans le pancréas ou autour de celui ci, mais il existe des topographies ectopiques (hépatique, rénale ou splénique notamment en sous capsulaire).
En TDM, le pseudo-kyste est de forme ronde ou ovalaire, de densité liquidienne < 20UH, et limité par une fine capsule réhaussée par le contraste. Leur contenu est de densité généralement homogène, mais peut être hétérogène (remaniements hémorragiques, infection). Une densité spontanée intrakystique > 50UH évoque une hémorragie intrakystique. La présence de bulles de gaz doit faire suspecter une infection du pseudo-kyste.
Complications des pseudo-kystes:
Elles sont dominées par la compression des organes de voisinage, l’infection et l’hémorragie par rupture de faux anévrisme (cf).
Autres collections liquidiennes : 3 autres types de collections au profil évolutif différent sont individualisés(3) :
- Les collections liquidiennes aiguës s’installent dans les premiers jours d’une PA sévère. Elles ne sont pas organisées, n’ont pas de paroi et peuvent régresser spontanément ou évoluer vers un pseudo-kyste.
- La nécrose pancréatique infectée constitue la complication locale la plus grave responsable de 50 à 80% des décès. Le risque de surinfection débute dès la fin de la 1ère semaine et se prolonge jusqu’à la 3ème semaine, pour décroître secondairement(17). L’infection est polymicrobienne dans la motié des cas, les germes les plus fréquemment retrouvés étant les bactéries à Gram négatif de type Entérobactéries et les anaérobies.
Le diagnostic clinique et biologique est difficile, la fièvre et l’augmentation de la CRP étant des signes habituels au cours d’une PA sans surinfection associée.
Le diagnostic TDM est également délicat mais doit être suspecté devant l’apparition de bulles d’air au sein des coulées nécrotiques (autre exemple). Le prélèvement des coulées sous guidage scanographique, sous asepsie stricte, est le plus souvent nécessaire pour confirmer le diagnostic de nécrose surinfectée et orienter le traitement.
- L’abcès pancréatique se présente au scanner comme une collection liquidienne homogène organisée et bien limitée, à parois parfois réhaussées, située à proximité du pancréas, et pouvant contenir une ou plusieurs bulles d’air. Le diagnostic doit être évoqué lorsque l’on se trouve en présence de ce type de collection chez un patient septique 3 à 4 semaines après le début de la PA.
Complications digestives:
Souffrance digestive (gastrite, duodénite, colite de contact) :
Secondaire à une inflammation au contact des foyers de pancréatite, ou plus rarement à une souffrance par ischémie veineuse. La localisation dépend de la topographie de l’atteinte pancréatique et l’évolution est variable : résolution ad integrum, aggravation avec nécrose et perforation, fistules, sténoses.
La TDM s’attachera à rechercher :
- un épaississement pariétal du segment digestif atteint associé à une infiltration de la graisse périphérique
- un défaut ou une absence de réhaussement pariétal en cas de nécrose
- un pneumopéritoine, une pneumatose pariétale, une aéromésentérie ou une aéroportie sont des signes de gravité majeurs
Sténose digestive (duodénale, colique) :
Complication tardive, multifactorielle, par proximité de l’atteinte inflammatoire, atteinte ischémique ou compression par un pseudo-kyste.
Elle se traduit en imagerie par une réduction de la lumière du segment digestif atteint en regard de l'obstacle avec dilatation d'amont. Une sténose duodénale doit faire évoquer une DKPA (cf).
Fistule digestive :
Par diffusion de la nécrose avec érosion des parois digestives, auxquels peuvent se surajouter des phénomènes ischémiques. L’angle colique gauche et le colon gauche sont les sièges les plus fréquemment touchés. Fistules internes/externes…
Autres compressions d’organes de voisinage:
VBP, pouvant occasionner un ictère
Uretère, pouvant être responsable d'une colique néphrétique.
Complications spléniques(18) :
Infarctus : suspecté devant l’existence d’hypodensités triangulaires intraparenchymateuses, à base sous-capsulaire et à sommet hilaire
Rupture : se traduisant par un hématome sous capsulaire ou un hémopéritoine
Collections liquidiennes intraspléniques : par extension d’une coulée de nécrose ou d’un pseudokyste le long du pédicule splénique
Epanchement des séreuses
Ascite pancréatique :
Généralement observée tardivement chez des patients ayant une pancréatite chronique calcifiante aux antécédents de multiples poussées aiguës, l’ascite pancréatique correspond à la présence de façon chronique d’un épanchement intrapéritonéal abondant lié à l’accumulation de suc pancréatique par une fistule à partir d’un canal excréteur. L’imagerie retrouve, à distance des épisodes aigus, un épanchement intrapéritonéal de grande abondance, non spécifique. L’analyse du liquide de ponction permet de confirmer le diagnostic en mettant en évidence un liquide exsudatif avec un taux d’amylasémie>1000UI.
Epanchement pleural (et/ou péricardique) :
en rapport avec une atteinte inflammatoire réactionnelle de la plèvre (et/ou du péricarde) ou à une fistule pancréatico-pleurale (et/ou péricardique). L’épanchement pleural est plus fréquent à gauche. La ponction ramène un liquide exsudatif avec une augmentation du taux d’amylase et de lipase.
Références bibliographiques :
1. Yousaf M, McCallion K, Diamond T. Management of severe acute pancreatitis. Br J Surg 2003 avr;90(4):407–420.
2. Laurens B, Leroy C, André A, Etienne B, Sergent-Baudson G, Ernst O. Imagerie des pancréatites aiguës. J Radiol 2005 juin;86(6 Pt 2):733–747
3. Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992. Arch Surg 1993 mai;128(5):586–590.
4. Balthazar EJ. Complications of acute pancreatitis: clinical and CT evaluation. Radiol. Clin. North Am. 2002 déc;40(6):1211–1227.
5. Chevallier P, Baudin G., Cocco L., Novellas S. Pancréatite aiguë. Dans: Imagerie de l’abdomen. Paris: Vilgrain V, Regent D.; 2010 p. 483–498.
6. Balthazar EJ, Robinson DL, Megibow AJ, Ranson JH. Acute pancreatitis: value of CT in establishing prognosis. Radiology 1990 févr;174(2):331–336.
7. Merkle EM, Görich J. Imaging of acute pancreatitis. Eur Radiol 2002 août;12(8):1979–1992.
8. Fujiwara T, Takehara Y, Ichijo K, Tooyama N, Kodaira N, Yamamoto H, Watahiki H. Anterior extension of acute pancreatitis: CT findings. J Comput Assist Tomogr 1995 déc;19(6):963–966.
9. Diche T, Bruckert F, Coffin C, Mathieu D. Pancréatite aiguë. Dans: Vilgrain V, Menu Y.Imagerie du foie, des voies biliaires, du pancréas et de la rate, Médecine-Sciences Flammarion. Paris: 2002 p. 363–81.
10. Novellas S, Karimdjee BS, Gelsi E, Baudin G, Chevallier P. [CT imaging features and significance of gas in the pancreatic bed]. J Radiol 2009 févr;90(2):191–198.
11. Malka D, Rosa-Hézode I. [Positive and etiological diagnosis of acute pancreatitis]. Gastroenterol. Clin. Biol. 2001 janv;25(1 Suppl):1S153–168.
12. Baron RL. Diagnosing choledocholithiasis: how far can we push helical CT? Radiology 1997 juin;203(3):601–603.
13. Delabrousse E, Di Martino V, Aubry S, Fein F, Sarliève P, Carbonnel F, Kastler BA. The choledochal ring sign: a specific finding in acute biliary pancreatitis. Abdom Imaging 2008 juin;33(3):337–341.
14. De Waele E, Op de Beeck B, De Waele B, Delvaux G. Magnetic resonance cholangiopancreatography in the preoperative assessment of patients with biliary pancreatitis. Pancreatology 2007;7(4):347–351.
15. Schmidt S, Chevallier P, Novellas S, Gelsi E, Vanbiervliet G, Tran A, Schnyder P, Bruneton JN. Choledocholithiasis: repetitive thick-slab single-shot projection magnetic resonance cholangiopancreaticography versus endoscopic ultrasonography. Eur Radiol 2007 janv;17(1):241–250.
16. Balthazar EJ, Ranson JH, Naidich DP, Megibow AJ, Caccavale R, Cooper MM. Acute pancreatitis: prognostic value of CT. Radiology 1985 sept;156(3):767–772.
17. Bradley EL 3rd, Allen K. A prospective longitudinal study of observation versus surgical intervention in the management of necrotizing pancreatitis. Am. J. Surg. 1991 janv;161(1):19–24; discussion 24–25.
18. Fishman EK, Soyer P, Bliss DF, Bluemke DA, Devine N. Splenic involvement in pancreatitis: spectrum of CT findings. AJR Am J Roentgenol 1995 mars;164(3):631–635.
| < Précédent | Suivant > |
|---|





