PANCREATITE CHRONIQUE :
La pancréatite chronique (PC) est une maladie inflammatoire chronique et fibrosante conduisant progressivement à la destruction irréversible du parenchyme exocrine, et à un stade avancé du parenchyme endocrine. Elle touche 10 fois plus les hommes que les femmes et survient généralement entre 35 et 45 ans, soit 10 ans avant l’âge médian de diagnostic de cirrhose alcoolique(1–5). L’intoxication éthylique est de loin la cause la plus fréquente, représentant environ 85% des étiologies de PC.
On distingue classiquement 3 types de PC(6) :
- les PC primitives (calcifiantes et non calcifiantes), non obstructives : les causes reconnues, en dehors de l’alcool, sont l’hypercalcémie, l’hyperlipidémie, les PC génétiques (héréditaires à transmission autosomique dominante, autosomique récessive, et la mucoviscidose), les PC tropicales, les PA récidivantes (d’origine ischémique, postradique et après PA nécrosante sévère) et les PC idiopathiques.
- les PC secondaires, obstructives (calcifiantes et non calcifiantes) : elles surviennent en amont d’un obstacle sur le canal de Wirsung (cancer de la tête, ampullome vatérien, sténose bénigne du sphincter d’Oddi, séquelles de pancréatite aiguë ou de pseudo-kyste, dystrophie kystique de la paroi duodénale)
- les pancréatites inflammatoires liées aux maladies auto-immunes
Le diagnostic de PC repose sur des critères anamnestiques, cliniques et d’imagerie (morphologique et fonctionnelle). Le rôle de l’imagerie, et en particulier de l’imagerie en coupes est donc essentiel pour :
- établir le diagnostic de PC par la détection d’altérations morphologiques des canaux et du parenchyme et évaluer l’atteinte fonctionnelle de la glande
- détecter les complications associées (pseudo-kystes, sténose biliaire, complications vasculaires : veineuses et artérielles)
- identifier les sous-groupes de PC et en particulier les formes auto-immunes et paraduodénales
- aider à la décision thérapeutique et assurer le suivi
Diagnostic de PC :
Si le diagnostic de pancréatite chronique peut être évoqué sur la présence de calcifications de l’aire pancréatique sur un cliché d’ASP ou à l’échographie, l’imagerie en coupe est nécessaire pour établir un bilan précis de l’atteinte parenchymateuse et canalaire, et ainsi guider la prise en charge thérapeutique.
Le trépied diagnostic est formé par l’association(6; 7) :
- parenchymateuses et/ou canalaires
- 85% au bout de 15 ans d’évolution
- initialement formées dans les canaux secondaires, pouvant rejoindre secondairement le canal de Wirsung
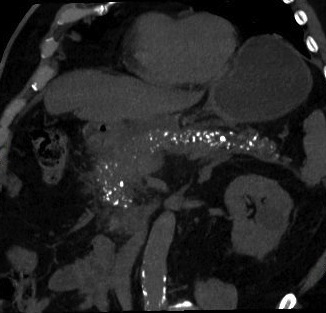
- étudiées au mieux en TDM, sur les coupes sans injection de produit de contraste, où elles apparaissent sous la forme de dépôts hyperdenses de tonalité calcique
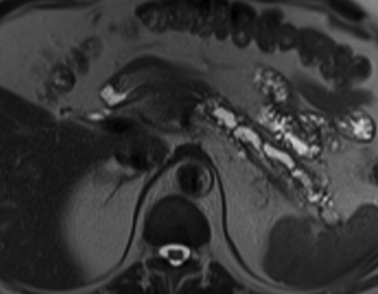
- peuvent être visibles en IRM sous la forme de lacunes en hyposignal (axial T2, coronal T2, bili IRM) sur l’ensemble des séquences
- de répartition, de morphologie et de taille variables
- pathognomoniques de la maladie
- plus nombreuses dans les stades avancés et dans les formes sévères
- plus fréquentes dans les PC alcooliques et héréditaires que dans les formes secondaires obstructives
- à distinguer des calcifications vasculaires, notamment de l’artère splénique
- peut être visible mais appréciée au mieux
- directement proportionnelle à l’extension et au degré de fibrose
- atteinte du canal de Wirsung
♦ alternance de sténoses/dilatations
♦ dilatation habituellement irrégulière, moniliforme (exemple tdm, exemple irm), mais pouvant être régulière dans les PC en amont d’un obstacle
♦ atteinte diffuse ou focale
- dilatations linéaires non kystiques des canaux secondaires (autre exemple)
- des modifications du parenchyme, de la taille et des contours de la glande
- des signes traduisant l’atteinte inflammatoire et fibrosante du parenchyme pancréatique:
♦ après injection de contraste, en TDM et en IRM : diminution du réhaussement à la phase artérielle pancréatique et un réhaussement plus important persistant sur les acquisitions tardives
♦ un hyposignal T1FatSat en IRM
- atrophie pancréatique dans les formes évoluées
- tuméfaction diffuse ou focale du pancréas lorsqu’il existe une poussée de pancréatite aiguë surajoutée(cf)
Apports respectifs de la TDM et de l’IRM :
Apport de la TDM :
- La TDM reste encore aujourd’hui la technique de choix du fait des progrès des scanners multidétecteurs de dernière génération concernant la résolution spatiale et la vitesse d’acquisition, de sa grande facilité d’accès dans la plupart des centres et de son moindre coût comparativement à l’IRM.
- La TDM reste le meilleur examen pour la détection des calcifications parenchymateuses et canalaires, pilier du diagnostic de PC.
- Elle permet de faire un bilan exhaustif des complications avant décision thérapeutique.
- Ses limites sont le diagnostic des formes débutantes de PC et le diagnostic différentiel entre pseudo-masse inflammatoire et carcinome pancréatique.
Apport de l’IRM :
- L’IRM est toujours peu sollicitée pour le diagnostic de PC du fait de son coût et de son accessibilité réduite. A l’exception de la détection des calcifications, elle égale le scanner pour le diagnostic positif et le diagnostic des complications. Elle offre, en un seul examen et sans irradiation, une évaluation précise des altérations de signal parenchymateux, de l’atteinte des canaux pancréatiques et permet une appréciation de la fonction pancréatique exocrine.
- L’IRM est utile pour diagnostiquer les formes débutantes de PC, de diagnostic difficile, en aval d’une exploration TDM non concluante. Dans les formes débutantes, les altérations morphologiques touchent initialement les canaux secondaires, qui apparaissent ectasiques mais non kystiques, avec une sténose du pied du canal. L’atteinte du canal principal peut être focale ou segmentaire, avec à un stade débutant, des irrégularités de contour et un aspect sinueux du conduit. L’alternance dilatations/sténoses courtes étagées, plus caractéristiques de la PC, apparaît secondairement.
- L’IRM avec injection de sécrétine permet de dépister une pancréatite chronique débutante, chez des patients ayant des douleurs abdominales à répétition avec élévation des enzymes pancréatiques, sans anomalie morphologique ni calcifications sur le scanner et l’IRM(8–12). L’injection intra-veineuse de Sécrétine (Sécrélux® - Sanochemia Diagnostics Deutschland GmbH, Neuss, Allemagne) permet d’apprécier de manière non invasive la morphologie canalaire pancréatique, la cinétique de vidange ainsi que la fonction secrétoire. La sécrétine est une hormone secrétée par la muqueuse duodénale qui stimule la sécrétion exocrine bicarbonatée du pancréas et qui augmente le tonus du sphincter d’Oddi. La dose est de 1UI/kg en injection IV de 1 à 2 minutes. Son obtention est soumise à une Autorisation Temporaire d’Utilisation (ATU) auprès de l’AFSSAPS.
- Chez le sujet normal, la sécrétine ne met pas en évidence les canaux secondaires, à l’exception du canal de Santorini et du canal de l’uncus. Après administration de sécrétine, il existe une augmentation transitoire du diamètre du canal principal, maximale entre la 2ème et la 5ème minute, et un retour progressif aux valeurs basales avec remplissage concomitant du cadre duodénal au delà de 10 minutes(13).
- Dans la pancréatite chronique débutante(12; 14), il existe une visualisation anormale des branches collatérales, l’apparition progressive d’une parenchymographie (visualisation du parenchyme pancréatique liée à l’accumulation du liquide sécrété au sein du tissu glandulaire), la persistance de la dilatation du canal principal au delà de 5 mn ainsi qu’une diminution du remplissage duodénal. La diminution du remplissage duodénal est appréciée par le score de Matos(13).
- Les séquences de diffusion, complémentaires des séquences conventionnelles, montrent de façon non spécifique comme dans toute prolifération cellulaire, qu’elle soit tumorale, inflammatoire ou fibreuse, une restriction des mouvements des molécules d’eau. Cela se traduit par une diminution du coefficient apparent de diffusion au sein des tissus et une augmentation du signal IRM en imagerie pondérée diffusion. Ces séquences, encore aujourd’hui à l’essai, peuvent toutefois s’avérer intéressantes dans l’évaluation des complications de la PC : les indications potentielles pourraient concerner la détection de poussées inflammatoires aiguës, de signes d’infection au sein d’un pseudo-kyste et la recherche de lésion nodulaire dans les suspicions de cancer sur PC(6). Sous utilisées en pratique quotidienne, le faible temps nécessaire pour leur acquisition devrait rendre leur usage systématique dans le bilan d’une PC, et de façon plus générale dans l’exploration de toute pathologie pancréatique.
- En présence d’une sténose isolée du canal de Wirsung, sans lésion tumorale identifiable, l’IRM avec administration de sécrétine est indiquée pour mettre en évidence un remplissage de la sténose et des canaux secondaires, arguments indirects en faveur de la bénignité.
- L’IRM trouve aussi sa place avant un traitement endoscopique pour détecter un pancréas divisum (imposant un abord par la papille accessoire) et pour évaluer la réserve exocrine en amont d’une sténose(6).
- En cas de pseudo-kyste, les séquences conventionnelles et de diffusion informent sur son contenu et ses rapports topographiques. La CP-IRM précise l’intégrité du canal de Wirsung et recherche une éventuelle communication avec le pseudo-kyste.
Imagerie des complications :
Elles sont nombreuses et diagnostiquées par le scanner et/ou l’IRM :
- Pseudo-kystes :
- complication principale de la PC, retrouvés dans 30 à 50% des cas
- généralement extrapancréatiques, siègeant préférentiellement autour du corps et de la région caudale(15)
- on distingue les pseudo-kystes nécrotiques, secondaires à l’organisation d’une coulée à la suite d’une poussée de pancréatite aiguë, des pseudo-kystes rétentionnels survenant lors d’un blocage du canal de Wirsung par un amas protéique, un calcul ou une sténose fibreuse localisée avec rupture canalaire d’amont(16).
- collection de forme arrondie ou ovalaire, limitée par une fine capsule (tissu de granulation) pouvant se rehausser après injection, homogène, de densité liquidienne inférieure à 20UH au TDM en l’absence de complications, en hypersignal T2/hyposignal T1 à l’IRM
- les pseudo-kystes peuvent saigner, s’infecter, être compressifs sur les structures de voisinage ou plus rarement se rompre dans la plèvre, le péritoine ou la veine porte
- infection de pseudo-kyste: elle est suspectée devant une augmentation de la densité du kyste en TDM, une hétérogénéité du signal en IRM, uen paroi épaisse et irrégulière, une densification de la graisse périphérique, la présence de bulles d’air au sein du kyste
- hémorragie intra-kystique: doit être évoquée devant un contenu kystique de densité spontanée > 40-50 UH
- Poussées aiguës (cf) : A l’origine d’exacerbations douloureuses, elles se traduisent par une augmentation focale du volume de la glande, une densification de la graisse péri-pancréatique, un épaississement des fascias pararénaux et des coulées nécrotiques pouvant secondairement s’abcéder.
- Biliaires : Sténose de la voie biliaire principale (VBP) :
- secondaire à la fibrose du pancréas céphalique, mais peut accompagner une poussée de PA ou plus rarement résulter d’une compression par un pseudo-kyste(17)
- il s’agit d’une sténose longue et progressive, incomplète, d’aspect effilée « en queue de radis»
- avec dilatation d’amont de la VBP et des voies biliaires intrahépatiques
- avec ou sans lithiase, mieux détectées en CP-IRM (lacunes arrondies ou ovalaires en hyposignal moulées par l’hypersignal liquidien de la bile) qu’en TDM (images nodulaires plus ou moins denses en fonction de la composition chimique du calcul, parfois non visibles au scanner)
- une majoration de la dilatation biliaire doit faire rechercher une poussée aiguë ou un cancer de la tête
- l’atteinte biliaire est mieux appréciée en IRM et en cholangio-IRM
- les 2 principales complications de la compression de la VBP sont l’angiocholite, qui peut se compliquer d’abcès intrahépatiques, et la cirrhose biliaire secondaire
- Epanchements séreux (péritonéal ou plus rarement pleural) :
- par rupture de pseudo-kystes ou fistules
- diagnostiqués au TDM, la communication canalaire ou avec le kyste peut être objectivée par la CP-IRM
- Compression duodénale :
- par un pseudo-kyste ou en rapport avec la fibrose pancréatique
- se traduit en imagerie par une réduction de la lumière duodénale (le plus souvent D2) en regard de l’obstacle avec dilatation d’amont
- Complications vasculaires :
- Les pseudo-anévrismes ou faux anévrismes(18) sont la conséquence d’une érosion de la paroi artérielle par un pseudokyste. Ils s’agit de formations nodulaires développées le long de trajets artériels, hyperdenses en contraste spontané et qui se réhaussent intensément comme l’aorte au temps artériel de l’injection. Les artères les plus souvent touchées sont par ordre de fréquence décroissante les artères spléniques, gastro-duodénales, pancréatico-duodénale, gastrique gauche et hépatique(19). Les reconstructions multiplanaires en mode MIP (Maximum Intensity Projection) et en rendu de volume (Volume Rendering) sont essentielles pour le bilan diagnostique et préthérapeutique.
- Les thromboses veineuses touchent l’axe splénique et s’accompagnent d’une hypertension portale segmentaire gauche. L’imagerie retrouve, en plus de l’obstacle veineux, une splénomégalie et la présence d’une circulation veineuse collatérale périgastrique (veines gastro-épiploïques, de la petite courbure).
- Complications spléniques (pseudo-kystes, hématomes sous capsulaires, rupture) : Elles sont souvent associées à une thrombose veineuse splénique.
- Cancer (cf)
Formes particulières de pancréatite chronique
- Pancréatite génétique: (cf)
- Pancréatite auto-immune : (cf)
- Pancréatite paraduodénale/Groove pancreatitis/Pancréatite du sillon/DKPA (cf)
Diagnostics différentiels :
- PC et cancer : Les patients atteints de PC ont un risque accru de développer un cancer du pancréas (cf)(20). Le diagnostic différentiel est parfois difficile, ce d’autant que la maladie est avancée et qu’elle s’accompagne d’importants remaniements parenchymateux. Les signes devant alerter sont l’apparition d’un ictère, la persistance de douleurs en dehors d’une poussée aiguë, une élévation des marqueurs tumoraux. A l’imagerie, on recherchera des modifications morphologiques et structurelles de la glande pancréatique : majoration d’une dilatation canalaire, majoration d’une sténose biliaire, modification des contours, apparition d’un nodule hypovasculaire.
Le TEP-TDM peut orienter vers un cancer en cas de SUV> 4 (Se : 91% ; Sp :87%) (21).
- PC et TIPMP : Dans la TIPMP, l’atteinte du canal principal se présente sous la forme d’une dilatation homogène, régulière, sans image de sténose, alors que dans la PC la dilatation est irrégulière, avec une dilatation passive des canaux secondaires, c’est à dire plutôt linéaire et non kystique, et s’accompagne d’une atrophie du parenchyme. Un foyer de PC peut s’observer en amont d’une TIPMP segmentaire du canal principal. En présence de signes de PC, le diagnostic de TIPMP d’un canal secondaire peut s’avérer difficile et requérir à la CPRE diagnostique.
Dans un contexte de PC, l’imagerie non invasive doit pouvoir :
- Confirmer le diagnostic de PC chez un patient faisant des pancréatites à répétition et dont le bilan d’imagerie est jusque là négatif.
- Rechercher un cancer du pancréas chez un patient ayant une PC évoluant depuis de longues années et présentant une récidive de sa symptomatologie douloureuse
- Rechercher une pancréatite auto-immune dans un contexte de cholestase avec obstruction biliaire, sans calcifications pancréatiques.
Références bibliographiques :
1. Gastard J, Joubaud F, Farbos T, Loussouarn J, Marion J, Pannier M, Renaudet F, Valdazo R, Gosselin M. Etiology and course of primary chronic pancreatitis in Western France. Digestion 1973;9(5):416–428.
2. Ammann RW, Akovbiantz A, Largiader F, Schueler G. Course and outcome of chronic pancreatitis. Longitudinal study of a mixed medical-surgical series of 245 patients. Gastroenterology 1984 mai;86(5 Pt 1):820–828.
3. Levy P, Milan C, Pignon JP, Baetz A, Bernades P. Mortality factors associated with chronic pancreatitis. Unidimensional and multidimensional analysis of a medical-surgical series of 240 patients. Gastroenterology 1989 avr;96(4):1165–1172.
4. Dani R, Mott CB, Guarita DR, Nogueira CE. Epidemiology and etiology of chronic pancreatitis in Brazil: a tale of two cities. Pancreas 1990 juill;5(4):474–478.
5. Layer P, Yamamoto H, Kalthoff L, Clain JE, Bakken LJ, DiMagno EP. The different courses of early- and late-onset idiopathic and alcoholic chronic pancreatitis. Gastroenterology 1994 nov;107(5):1481–1487.
6. Matos C, Baleato S. Pancréatite chronique. Dans: Imagerie de l’abdomen. Paris: Vilgrain V, Regent D.; 2010 p. 501–522.
7. Remer EM, Baker ME. Imaging of chronic pancreatitis. Radiol. Clin. North Am. 2002 déc;40(6):1229–1242, v.
8. Manfredi R, Costamagna G, Brizi MG, Maresca G, Vecchioli A, Colagrande C, Marano P. Severe chronic pancreatitis versus suspected pancreatic disease: dynamic MR cholangiopancreatography after secretin stimulation. Radiology 2000 mars;214(3):849–855.
9. Cappeliez O, Delhaye M, Devière J, Le Moine O, Metens T, Nicaise N, Cremer M, Stryuven J, Matos C. Chronic pancreatitis: evaluation of pancreatic exocrine function with MR pancreatography after secretin stimulation. Radiology 2000 mai;215(2):358–364.
10. Gillams AR, Lees WR. Quantitative secretin MRCP (MRCPQ): results in 215 patients with known or suspected pancreatic pathology. Eur Radiol 2007 nov;17(11):2984–2990.
11. Schlaudraff E, Wagner H-J, Klose KJ, Heverhagen JT. Prospective evaluation of the diagnostic accuracy of secretin-enhanced magnetic resonance cholangiopancreaticography in suspected chronic pancreatitis. Magn Reson Imaging 2008 déc;26(10):1367–1373.
12. Sai J-K, Suyama M, Kubokawa Y, Watanabe S. Diagnosis of mild chronic pancreatitis (Cambridge classification): comparative study using secretin injection-magnetic resonance cholangiopancreatography and endoscopic retrograde pancreatography. World J. Gastroenterol. 2008 févr;14(8):1218–1221.
13. Matos C, Metens T, Devière J, Nicaise N, Braudé P, Van Yperen G, Cremer M, Struyven J. Pancreatic duct: morphologic and functional evaluation with dynamic MR pancreatography after secretin stimulation. Radiology 1997 mai;203(2):435–441.
14. Matos C, Devière J, Cremer M, Nicaise N, Struyven J, Metens T. Acinar filling during secretin-stimulated MR pancreatography. AJR Am J Roentgenol 1998 juill;171(1):165–169.
15. Klöppel G, Maillet B. Pseudocysts in chronic pancreatitis: a morphological analysis of 57 resection specimens and 9 autopsy pancreata. Pancreas 1991 mai;6(3):266–274.
16. Andrén-Sandberg A, Dervenis C. Pancreatic pseudocysts in the 21st century. Part I: classification, pathophysiology, anatomic considerations and treatment. JOP 2004 janv;5(1):8–24.
17. Lesur G, Lévy P, Flejou JF et al. Factors predictive of liver histopathological appearance in chronic alcoholic pancreatitis with common bile duct stenosis and increased serum alkaline phosphatase. Hepatology, 1993, 18 : 1078-1081.
18. Giammanco M, Costantino S, Lo Nigro RM, Buscemi G. [Pseudoaneurysm in pancreatic pseudocysts. Report of a clinical case]. Minerva Chir 1995 déc;50(12):1081–1084.
19. Mallick IH, Winslet MC. Vascular complications of pancreatitis. JOP 2004 sept;5(5):328–337.
20. Malka D, Hammel P, Maire F, Rufat P, Madeira I, Pessione F, Lévy P, Ruszniewski P. Risk of pancreatic adenocarcinoma in chronic pancreatitis. Gut 2002 déc;51(6):849–852.
21. van Kouwen MCA, Jansen JBMJ, van Goor H, de Castro S, Oyen WJG, Drenth JPH. FDG-PET is able to detect pancreatic carcinoma in chronic pancreatitis. Eur. J. Nucl. Med. Mol. Imaging 2005 avr;32(4):399–404.
| < Précédent | Suivant > |
|---|





