TUMEUR ENDOCRINE DU PANCREAS :
Les tumeurs endocrines du pancréas (TEP) sont rares: elles représentent 3% des tumeurs pancréatiques et moins de 5% de l’ensemble des tumeurs endocrines (1). Ces tumeurs sont sporadiques dans 95% des cas mais elles peuvent s’intégrer dans des syndromes de prédisposition aux tumeurs comme la néoplasie endocrine multiple de type 1 (NEM 1) ou la maladie de Von Hippel Lindau, plus rarement la sclérose tubéreuse de Bourneville ou la neurofibromatose de type 1 (2; 3). Les TEP forment un groupe très hétérogène de tumeurs et sont classées histologiquement depuis 2004 en (4): tumeurs endocrines bien différenciées (TEBD) à comportement bénin, TEBD à comportement incertain, carcinomes endocrines bien différenciés de faible grade, et carcinomes endocrines (à grandes et petites cellules) peu différenciés de haut grade.
On distingue classiquement les tumeurs endocrines fonctionnelles, diagnostiquées précocément lors de l’apparition d’une symptomatologie spécifique liée à l’hypersécrétion hormonale (insuline, gastrine, glucagon, VIP, somatostatine ou sérotonine), des tumeurs non fonctionnelles (Annexe).
Les tumeurs non fonctionnelles (30% des TEP) en raison de leur révélation tardive par des symptomes aspécifiques, sont des tumeurs de grande taille et sont souvent d’emblée métastatiques. A l’opposé les tumeurs fonctionnelles sont généralement de petite taille (<2cm) au stade de découverte(5). Il est important de noter qu’une tumeur non fonctionnelle n’est pas forcément non sécrétante: il peut s’agir soit d’un faible taux d’hormone, soit de la sécrétion d’un produit inactif (6).
L’imagerie joue un rôle primordial dans la localisation de la tumeur primitive, en permettant de faire un bilan d’extension local et à distance, d’assurer le suivi après traitement, de rechercher un syndrome de prédisposition aux tumeurs et de rechercher un second cancer associé.
Imagerie de la tumeur primitive(5):
Le bilan d’imagerie de la tumeur primitive est caractérisé par sa multidisciplinarité associant des méthodes d’imagerie morphologique (échographie, TDM, IRM), des techniques d’imagerie endoscopique (écho-endoscopie), des techniques d’imagerie métabolique (octréo-scan, PET-TDM)) et des techniques d’imagerie vasculaire de moins en moins utilisées (artériographie, prélèvements veineux étagés).
Echographie:
Elle permet de rechercher la tumeur primitive, qui apparaît sous la forme d’une masse hypoéchogène bien limitée, mais également d’éventuelles métastases hépatiques. Elle est limitée par sa faible résolution spatiale et par la présence fréquente d’interpositions gazeuses.
C’est la technique de référence. En plus d’apprécier l’atteinte vasculaire et ganglionnaire, elle permet la réalisation de biopsies à l’aiguille fine.
Limites: gastrinomes duodénaux, tumeurs endocrines pancréatiques distales, adénopathies péripancréatiques, expérience de l’opérateur, limites d’ordre technique (gastrectomie totale ou partielle) et général (anesthésie).
TDM :
L’aspect TDM des TEP est polymorphe, et varie selon le type de sécrétion et la taille de la tumeur. On en distingue plusieurs formes, par ordre de fréquence décroissante:
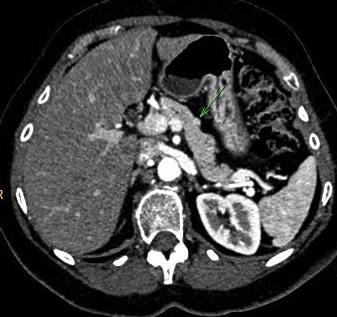
- la forme typique hypervascularisée: elle représente 45 à 55 % des tumeurs endocrines pancréatiques et est plus fréquemment retrouvée dans les insulinomes. Il s’agit :
- d’un nodule bien limité
- spontanément isodense ou hypodense avant injection de produit de contraste
- hyperdense après injection à la phase artérielle et/ou pancréatique - contrairement à l’adénocarcinome - cette hyperdensité par rapport au parenchyme pancréatique sain persistant généralement, mais de façon moins marquée, à la phase veineuse
- une prise de contraste précoce en anneau périphérique est parfois retrouvée et doit faire évoquer la nature endocrine de la tumeur
- l’autre forme fréquemment rencontrée, notamment dans les tumeurs non secrétantes et les gastrinomes, est la forme fibreuse qui représente 30 à 40 % des tumeurs endocrines pancréatiques :
- masse spontanément hypo ou isodense,
- plus ou moins calcifiée,
- prise de contraste progressive avec le temps: il s’agit donc de tumeurs hypodenses à la phase artérielle et hyperdenses à la phase tardive (3 minutes après le début de l’injection)
- plus rarement les formes kystiques, hypovascularisées ou calcifiées
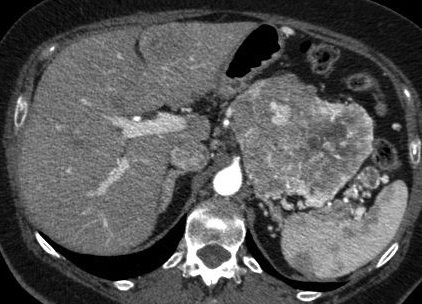
- enfin, les tumeurs non fonctionnelles, en raison de leur découverte tardive, se présentent de la façon suivante :
- volumineuse masse hétérogène (taille moyenne : 10 cm)
- présentant des remaniements nécrotico-hémorragiques
- souvent associées à un bourgeon veineux néoplasique de la veine splénique et/ou de la veine mésentérique supérieure
- métastases hépatiques dans presque 90 % des cas
Les TEP peuvent toucher indifféremment n’importe quelle portion du pancréas. Quelle que soit leur taille, elles peuvent entraîner une dilatation biliaire ou du canal de Wirsung d’amont, et une thrombose veineuse avec ou sans développement d’une circulation veineuse collatérale. L’engainement artériel est en revanche exceptionnel.
! Protocole : La phase pancréatique (40 secondes après le début de l’injection) est considérée par certains auteurs comme la plus sensible pour la détection de ces tumeurs(7). Un certain nombre de ces tumeurs n’étant visible qu’aux phases précoces de l’injection, la réalisation d’une série au temps artériel tardif (à 30 secondes) ou pancréatique (40secondes) est dans tous les cas indispensable(8). Une phase portale est indiquée puisque toutes les TEP ne présentent pas un réhaussement hypervasculaire et qu’une partie d’entre elles ne sera détectée exclusivement qu’au temps veineux de l’injection.
IRM :
L’IRM a une sensibilité comparable au TDM pour la détection des TEP(9; 10).
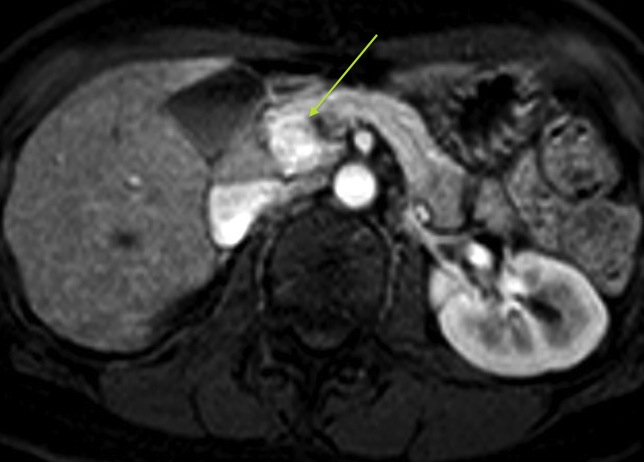
- sur les séquences T1 FatSat, la tumeur apparaît en hyposignal et est facilement visualisée du fait d’un très bon contraste avec le parenchyme pancrétique en hypersignal spontané.
- en pondération T2, la tumeur est le plus souvent en hypersignal, mais peut également être en hyposignal dans 30 % des cas.
- après injection de gadolinium, la prise de contraste est comparable à celle décrite en TDM, c’est-à-dire soit précoce à la phase artérielle dans les formes hypervascularisées (autre exemple), soit retardée et progressive dans les formes fibreuses (en IRM, les temps d’acquisition après injection sont différents qu’en TDM : la phase artérielle est acquise 15 secondes , la phase portale 90 secondes et la phase tardive 2min 30 après le début de l’injection)
- l’imagerie de diffusion est actuellement peu utilisée en pratique quotidienne pour le diagnostic de TEP ; elle retrouve de façon non spécifique des coefficients apparents de diffusion constamment inférieurs dans la tumeur primitive à ceux du parenchyme pancréatique sain. La fusion virtuelle avec les séquences morphologiques (TEP-IRM) offre des perspectives intéressantes.
Scintigraphie des récepteurs à la somatostatine (SRS/Octréoscan®) :
Il s'agit d'un examen non invasif permettant la détection in vivo des récepteurs de la somatostatine exprimés par la majorité des tumeurs endocrines bien différenciées. Cet examen doit être réalisé de façon systématique dans tout bilan de TE, de préférence avant l’imagerie morphologique qu’elle va permettre d’orienter, tant pour la recherche de la tumeur primitive que pour le bilan d’extension pour lequel il permet un bilan corps entier. Les résultats de la scintigraphie des récepteurs de la somatostatine dépendent du siège de la tumeur primitive, du type de secrétions et de la taille de la tumeur. Sa sensibilité de détection est excellente pour les gastrinomes de plus de 2cm (90%), mais elle est limitée pour la détection des tumeurs primitives et des métastases de moins de 15 mm (sensibilité autour de 40%)(11; 12). De plus seuls 50% des insulinomes présentent une hyperfixation scintigraphique(12).
Tomographie par émission de positons au 18 F-FDG :
Ses indications sont actuellement limitées au bilan d’extension et au suivi des tumeurs endocrines peu différenciées non visualisées par la SRS.
Diagnostic différentiel :
Les principaux diagnostics différentiels sont représentés par les lésions pancréatiques hypervasculaires : métastases hypervasculaires, en particulier celles secondaires aux adénocarcinomes rénaux, localisations pancréatiques de myélome, rates accessoires intrapancréatiques et certaines malformations vasculaires.
Bilan d’extension :
Les sites métastatiques les plus fréquents des tumeurs endocrines malignes du pancréas sont le foie, les ganglions abdominaux et médiastinaux et l’os, ce qui justifie la réalisation d’un bilan d’extension systématique comprenant une TDM thoracique et abdomino-pelvienne et une scintigraphie des récepteurs de la somatostatine. Les métastases aux niveaux thoracique et osseux sont rares en l’absence de localisations hépatiques(5). La carcinose péritonéale est exceptionnelle dans les TEP (contrairement aux tumeurs endocrines iléales).
L’objectif principal de l’imagerie reste la recherche de métastases hépatiques de par leur fréquence et de l’importance de leur reconnaissance pour la prise en charge thérapeutique et le pronostic.
Ces métastases sont le plus souvent multiples et hypervascularisées, caractérisées par une prise de contraste intense au temps artériel, nécessitant la réalisation d’un TDM triphasique systématique pour augmenter la sensibilité de détection. Les autres aspects possibles sont : les formes hypovasculaires (16%), pseudo-angiomateuses (11%), purement fibreuses et les formes de miliaire hépatique avec de multiples métastases punctiformes millimétriques (22,5%)(13).
L’IRM apparaît plus sensible que la TDM dans la détection des métastases hypervasculaires de petite taille, grâce à une meilleure résolution en contraste sur les séquences T2, les séquences dynamiques à la phase artérielle de l’injection, et surtout sur les séquences de diffusion (séquence b50, b400, b800, correspondance t2)
La SRS permet de compléter le bilan d’extension en offrant une imagerie « corps entier » de grande spécificité, mais reste inférieure à l’imagerie classique (TDM et IRM) pour la détection des métastases hépatiques, pulmonaires et cérébrales(14).
Suivi après traitement :
Il est adapté au type histologique de la tumeur endocrine. Alors que les carcinomes peu différenciés nécessitent une surveillance rapprochée tous les 2 à 3 mois pour évaluer la réponse à la chimiothérapie, les TEBD requièrent un suivi espacé (tumeurs à temps de doublement long, plusieurs années étant souvent nécessaires pour mettre en évidence une progression lente).
Références bibliographiques :
1. Carriaga MT, Henson DE. Liver, gallbladder, extrahepatic bile ducts, and pancreas. Cancer 1995 janv;75(1 Suppl):171-190.
2. Halfdanarson TR, Rabe KG, Rubin J, Petersen GM. Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival. Ann. Oncol. 2008 oct;19(10):1727-1733.
3. Schlumberger M, Baudin E. [Neuroendocrine tumors]. Ann. Endocrinol. (Paris) 1997;58(2):95-99.
4. Klöppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann. N. Y. Acad. Sci. 2004 avr;1014:13-27.
5. Dromain C. Tumeurs endocrines du pancréas. Dans: Imagerie de l’abdomen. Paris: Vilgrain V, Regent D.; 2010 p. 474-481.
6. Scoazec J-Y. [Endocrine tumors: biology and physiopathology]. Ann Pathol 2005 déc;25(6):447-461.
7. Fidler JL, Fletcher JG, Reading CC, Andrews JC, Thompson GB, Grant CS, Service FJ. Preoperative detection of pancreatic insulinomas on multiphasic helical CT. AJR Am J Roentgenol 2003 sept;181(3):775-780.
8. Van Hoe L, Gryspeerdt S, Marchal G, Baert AL, Mertens L. Helical CT for the preoperative localization of islet cell tumors of the pancreas: value of arterial and parenchymal phase images. AJR Am J Roentgenol 1995 déc;165(6):1437-1439.
9. Ichikawa T, Peterson MS, Federle MP, Baron RL, Haradome H, Kawamori Y, Nawano S, Araki T. Islet cell tumor of the pancreas: biphasic CT versus MR imaging in tumor detection. Radiology 2000 juill;216(1):163-171.
10. Thoeni RF, Mueller-Lisse UG, Chan R, Do NK, Shyn PB. Detection of small, functional islet cell tumors in the pancreas: selection of MR imaging sequences for optimal sensitivity. Radiology 2000 févr;214(2):483-490.
11. Alexander HR, Fraker DL, Norton JA, Bartlett DL, Tio L, Benjamin SB, Doppman JL, Goebel SU, Serrano J, Gibril F, Jensen RT. Prospective study of somatostatin receptor scintigraphy and its effect on operative outcome in patients with Zollinger-Ellison syndrome. Ann. Surg. 1998 août;228(2):228-238.
12. Cadiot G, Mignon M, Gresze. [Diagnosis of endocrine tumors of the duodeno-pancreatic area]. Gastroenterol. Clin. Biol. 2003 mars;27(3 Suppl):S6-14.
13. Dromain C, de Baere T, Baudin E, Galline J, Ducreux M, Boige V, Duvillard P, Laplanche A, Caillet H, Lasser P, Schlumberger M, Sigal R. MR imaging of hepatic metastases caused by neuroendocrine tumors: comparing four techniques. AJR Am J Roentgenol 2003 janv;180(1):121-128.
14. Panzuto F, Falconi M, Nasoni S, Angeletti S, Moretti A, Bezzi M, Gualdi G, Polettini E, Sciuto R, Festa A, Scopinaro F, Corleto VD, Bordi C, Pederzoli P, Delle Fave G. Staging of digestive endocrine tumours using helical computed tomography and somatostatin receptor scintigraphy. Ann. Oncol. 2003 avr;14(4):586-591.
| < Précédent | Suivant > |
|---|





