TIPMP (Tumeur intracanalaire papillaire et mucineuse du pancréas) :
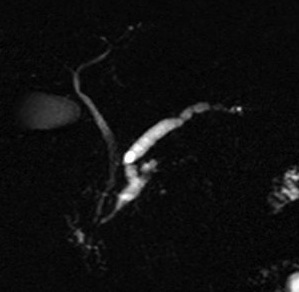
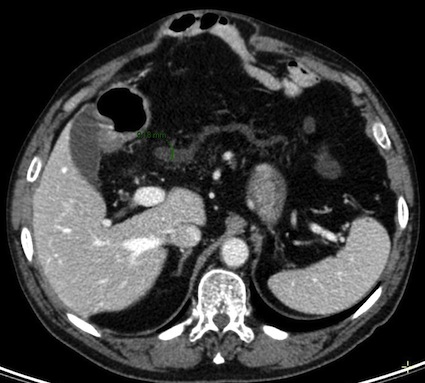
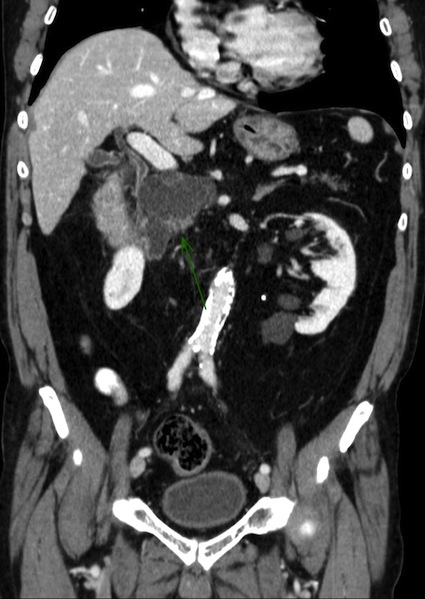
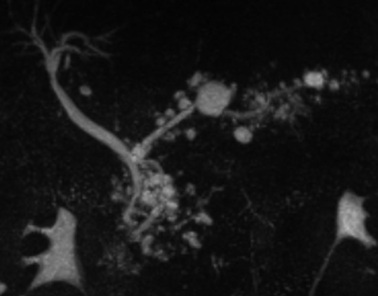
La tumeur intracanalaire papillaire et mucineuse du pancréas (TIPMP) fait partie du groupe des tumeurs kystiques du pancréas. Elle est caractérisée par une prolifération épithéliale papillaire du canal principal et/ou des canaux secondaires, responsable d’une hypersécrétion de mucus à l’origine d’une dilatation des canaux excréteurs. L’atteinte intéresse soit le canal pancréatique principal (CPP), soit les canaux secondaires, ou peut aussi être mixte. Il peut s’agir d’une hyperplasie simple (adénome), d’une dysplasie modérée (tumeur borderline), ou d’une lésion maligne avec un carcinome in situ (dysplasie de haut grade) ou un carcinome invasif (adénocarcinome)(1; 2). Il existe un continuum lésionnel entre ces stades évolutifs.
Il existe une discrète prédominance féminine avec un sex ratio de 0,86 et un âge médian de 64 ans lors du diagnostic(3). Les circonstances de découverte sont fortuites chez 1/3 des patients mais une douleur de type pancréatite, avec ou sans élévation enzymatique, est fréquente. Le diagnostic peut être évoqué à la suite d’un épisode de pancréatite aiguë, ce d’autant qu’il survient entre 50 et 60 ans chez un patient sans antécédent et que la cause biliaire est écartée. Ces pancréatites aiguës sont le plus souvent de faible gravité.
Diagnostic positif:
L’atteinte isolée du canal principal est rare, celle des canaux secondaires est retrouvée dans près de 30% des cas alors que les atteintes mixtes (canal principal et canaux secondaires) représentent plus de 2/3 des cas(4).
Si l’échographie et le TDM évoquent le diagnostic, c’est la cholangiopancréato-IRM ou l’écho-endoscopie qui permettent d’affirmer le diagnostic de TIPMP(5).
Tomodensitométrie(6–8) et IRM(8–11) :
- Atteinte du canal principal :
♦ >3mm (à pondérer en fonction de l'âge, le calibre du canal augmentant de façon physiologique avec l'âge et pouvant atteindre 6mm chez le vieillard)
♦ probabilité de TIPMP augmente avec le Ø du canal de Wirsung (seuil :6mm)
♦ pathognomonique si >15mm (tdm, irm)
♦ allant classiquement en augmentant vers la papille (accumulation du mucus dans le sens du flux)
- Parois régulières et rectilignes (tdm, irm), bords restant parallèles (contrairement à l’aspect moniliforme observé dans la
pancréatite chronique)
- Atteinte diffuse ou segmentaire
♦ Une dilatation d’un canal secondaire peut entraîner une dilatation focale du CPP, par écoulement de mucus sécrété par le canal secondaire pathologique. Lorsque la dilatation du canal de Wirsung est segmentaire, sans sténose d’aval, et sans canal secondaire ectasique en regard, le diagnostic de TIPMP segmentaire du CPP doit être évoqué.
- Rares calcifications endoluminales sur bouchons de mucus
- Atrophie parenchymateuse dans 1/3 des cas
- Atteinte des canaux secondaires :
- Lésions d’allure kystique : hypodensités d’allure liquidienne en TDM, fortement hyperintenses en T2 et
hypointenses en T1 en IRM, les parois ne se réhaussant pas après injection
- Caractère communiquant/branché avec le CPP
♦ c’est ce qui permet de porter le diagnostic de TIPMP
♦ si la communication peut être évoquée au TDM notamment avec les reconstructions de type « curved », elle doit être confirmée par l’IRM avec séquences de cholangiopancréato-IRM , qui est l’examen de choix pour mettre en évidence la communication, avec une sensibilité proche de 100% pour le diagnostic de TIPMP des canaux secondaires(10–13) . Les coupes fines de cholangiopancréato-IRM 3D améliorent l’analyse de l’anatomie de l’arbre bilio-pancréatique et augmentent la précision et la confiance diagnostique dans la mise en évidence de la communication des canaux secondaires ectasiques avec le CPP(14; 15)
- De forme tubulaire, ovalaires ou polylobées
- Uni ou multiloculées séparées par de fins septas, prenant un aspect « en grappe de raisins »
- De quelques millimètres jusqu’à 3 ou 4cm
- Caractère multiple et multifocal de l’atteinte canalaire très en faveur du diagnostic
♦ touchant préférentiellement le crochet et la queue du pancréas
- Contenu kystique homogène ou hétérogène (nodule mural, boule de mucus ou impaction mucoïde)
- Calcifications endoluminales punctiformes possibles
- Formes mixtes (autre exemple) : Ce sont les formes les plus fréquentes (70% des cas), assez caractéristiques de la maladie.
- Signes associés :
- Pancréatite : Une pancréatite aiguë peut être révélatrice d’une TIPMP. Une infiltration de la graisse péri-pancréatique secondaire aux poussées itératives de pancréatite aiguë et aux lésions de pancréatite fibrosante qui en découlent peut s’observer(16). L’atrophie pancréatique est plus importante dans la TIPMP du CPP (>10 ou 15 mm) que dans la pancréatite chronique(17), et résulte de l’obstruction canalaire chronique par le mucus.
- Calcifications : Des calcifications endoluminales développées sur les bouchons de mucus sont parfois observées et peuvent siéger dans les canaux secondaires ou dans le CPP. Elles seraient plus fréquemment associées à un risque de dégénérescence(6).
- Atteinte papillaire associée(3; 7)
♦ Une terminaison papillaire normale mesure entre 5 x 2 et 9 x 8 mm
♦ Une dilatation papillaire mesurant entre 5 x 5 et 15 x 12 mm s’observe dans environ 40% des cas
♦ Une protrusion de la papille dans la lumière duodénale est très spécifique du diagnostic et s’associe dans 20% des cas
- Fistules entre les canaux pancréatiques dilatés et les structures adjacentes, secondaires à l’érosion chronique des parois par le mucus : fistules pancréatico-duodénales, pancréatico-biliaires, pancréatico-coliques
Endoscopie :
La duodénoscopie et l’écho-endoscopie sont des méthodes performantes pour le diagnostic de TIPMP. La visualisation endoscopique d’une béance papillaire avec écoulement de mucus est pathognomonique de la maladie. L’écho-endoscopie, en plus de retrouver la communication entre les canaux secondaires ectasiques et le Wirsung, recherche des nodules muraux et fait le diagnostic différentiel avec des bouchons de mucus.
Diagnostic différentiel(8) :
- Atteinte du canal principal :
- Adénocarcinome :
♦ Syndrome de masse intraparenchymateux
♦ Sténose localisée avec disparité de calibre brutale
♦ Dilatation passive des canaux secondaires (et non « kystique ») qui prennent un aspect dit « en flammèches », rectiligne, à angle aigu
- Pancréatite chronique(17) :
♦ Terrain : homme (sex ratio 10 :1) au long passé éthylique
♦ Volumineuses calcifications canalaires et intraparenchymateuses au TDM
♦ Dilatation moniliforme, alternant sténoses peu serrées et dilatations irrégulières
♦ Bords irréguliers non rectilignes
♦ Dilatation modérée (<5mm)
♦ Dilatation passive des canaux secondaires « en flammèches », non ectasique
♦ Formes trompeuses :
• Une TIPMP de la tête ou du corps peut s’accompagner d’une pancréatite chronique d’amont
• TIPMP et PC peuvent être associées (éthylisme)
- Atteinte des canaux secondaires :
- Dilatation isolée d’un canal secondaire :
♦ Cystadénome séreux (cf) : en faveur de la TIPMP, il faut rechercher d’autres localisations kystiques branchées (le cystadénome séreux est généralement unique), une image canalaire/tubulaire au sein des kystes, l’absence de prise de contraste des cloisons
♦ Cystadénome mucineux (cf) : Tout comme les TIPMP, il s’agit d’une lésion mucineuse avec hyperplasie muqueuse et présence de stroma ovarien. Il s’agit le plus souvent d’un kyste rond, uniloculaire, à paroi épaisse qui prend le contraste. La lésion est unique, sans communication avec le CPP.
♦ Pseudo-kyste (cf) : Le diagnostic différentiel est parfois délicat car une lésion kystique pancréatique unique chez un patient aux antécédents de pancréatite aiguë peut très bien correspondre à un canal secondaire dilaté à l’origine de la pancréatite. Une lésion kystique ronde, à parois épaisses et au contenu hétérogène, parfois hémorragique, sont des arguments en faveur du pseudokyste. Une élévation des enzymes pancréatiques dans le liquide de ponction peut orienter mais n’est pas spécifique.
- Dilatation de plusieurs canaux :
♦ Transformation kystique des acini (ou cystadénome à cellules acineuses) : Lésion très rare de l’enfant et de l’adulte jeune, elle correspond à l’ectasie des canaux secondaires due à une hypersécrétion de suc pancréatique et non de mucus. Il n’y a pas de risque de dégénérescence. La distinction avec une TIPMP isolée des canaux secondaires de petite taille est parfois difficile, et la découverte est souvent fortuite sur l’analyse anatomo-pathologique des pièces opératoires. L’absence de caractère branché et le grand nombre des formations kystiques sont des éléments d’orientation.
♦ Maladie de von Hippel-Lindau : L’atteinte pancréatique associe des cystadénomes séreux, des kystes simples (non communiquants avec le CPP) et des tumeurs endocrines (cf)
♦ Polykystose : Multiples lésions kystiques simples non communicantes avec le CPP. Les kystes sont généralement de petite taille, infracentimétriques, sans paroi visible. L’association avec une polykystose rénale est la règle.
Diagnostic de malignité(7; 9; 10; 16) :
Les TIPMP isolées des canaux secondaires ont moins de risque de dégénérescence que les atteintes du canal principal ou les formes mixtes(3; 4).
- Signes directs :
- Masse tissulaire infiltrante (carcinome invasif) : lésion iso ou hypodense au TDM mal limitée envahissant le parenchyme, contenant des images kystiques en son sein, ne respectant pas les canaux: aspect similaire à celui d’un adénocarcinome
- Présence d’un bourgeon tissulaire endocanalaire/ Nodule mural (carcinome in situ)
♦ Image tissulaire, bien limitée, peu réhaussée au TDM ; lacune pariétale en bili-IRM (correspondance séquence T2)
♦ Les rares faux positifs sont les images nodulaires < 5mm qui peuvent correspondre à des impactions mucoïdes, qui au contraire des nodules muraux, ne sont pas rehaussées après injection.
L’échoendoscopie permet une bonne distinction entre le mucus, mobile, et les bourgeons
adhérents à la paroi en continuité avec la muqueuse
- Prise de contraste de la paroi du canal principal(11)
- Signes indirects :
- Dilatation canalaire
♦ >15mm pour le canal principal
♦ diffuse de l’ensemble du Wirsung
♦ >30 mm pour un canal secondaire, contenant un bourgeon (en l’absence de bourgeon associé, la dégénérescence est rare)
- Calcifications endoluminales
- Atteinte des voies biliaires
♦ Fistule biliaire responsable d’une dilatation de la VBP
- Extension :
- Envahissement vasculaire veineux de contiguïté, plus rarement artériel
- Rare : métastases hépatiques hypovasculaires, lymphangite carcinomateuse, carcinose péritonéale
Surveillance :
La surveillance des TIPMP a pour but de dépister précocement des signes en faveur d’une dégénérescence. Cette surveillance repose sur l’imagerie en coupe, l’IRM devant être préférée à la TDM du fait de la répétition des examens et de son caractère non irradiant. Elle dépend du type d’atteinte (atteinte ou non du canal principal) et de la taille des lésions les plus volumineuses. L’échoendoscopie réalisée en cas d’anomalie dépistée en TDM ou IRM est plus invasive. Elle est très sensible pour déceler les épaississements de la muqueuse et permet la biopsie des zones suspectes.
Le risque de développer un cancer ou une dysplasie de haut grade est de 50 % à 5 ans pour une atteinte du canal principal ou mixte, et de 15 % pour une atteinte des canaux secondaires(3; 4). Le mode de surveillance des TIPMP des canaux secondaires est fixé par la conférence de consensus japonaise de 2006(18).
Algorithme de surveillance des TIPMP des canaux secondaires selon la conférence de consensus internationale de 2006
(N.B: L'intervalle de suivi peut être allongé après 2 ans sans évolutivité.)
Références bibliographiques :
1. Ban S, Naitoh Y, Mino-Kenudson M, Sakurai T, Kuroda M, Koyama I, Lauwers GY, Shimizu M. Intraductal papillary mucinous neoplasm (IPMN) of the pancreas: its histopathologic difference between 2 major types. Am. J. Surg. Pathol. 2006 déc;30(12):1561-1569.
2. Vullierme MP, Giraud M, Hammel P, Couvelard A, Sauvanet A, Belghiti J, Ruszniewski P, Vilgrain V. [Intraductal papillary mucinous tumours of the pancreas: imaging features]. J Radiol 2005 juin;86(6 Pt 2):781-794; quiz 795-796.
3. Jouannaud V, Lévy P, Couvelard A. Risque actuariel de malignité des tumeurs papillaires mucineuses du pancréas. Gastroenterol Clin Biol 2004;28(hors série I):A89.
4. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, Bernades P, Belghiti J, Ruszniewski P, Fléjou JF. Intraductal papillary mucinous tumors of the pancreas confined to secondary ducts show less aggressive pathologic features as compared with those involving the main pancreatic duct. Am. J. Surg. Pathol. 2000 oct;24(10):1372-1377.
5. Waters JA, Schmidt CM, Pinchot JW, White PB, Cummings OW, Pitt HA, Sandrasegaran K, Akisik F, Howard TJ, Nakeeb A, Zyromski NJ, Lillemoe KD. CT vs MRCP: optimal classification of IPMN type and extent. J. Gastrointest. Surg. 2008 janv;12(1):101-109.
6. Taouli B, Vilgrain V, Vullierme MP, Terris B, Denys A, Sauvanet A, Hammel P, Menu Y. Intraductal papillary mucinous tumors of the pancreas: helical CT with histopathologic correlation. Radiology 2000 déc;217(3):757-764.
7. Fukukura Y, Fujiyoshi F, Sasaki M, Inoue H, Yonezawa S, Nakajo M. Intraductal papillary mucinous tumors of the pancreas: thin-section helical CT findings. AJR Am J Roentgenol 2000 févr;174(2):441-447.
8. Vullierme M-P, Palazzo L. Tumeur intracanalaire papillaire et mucineuse du pancréas. Dans: Imagerie de l’abdomen. Paris: Vilgrain V, Regent D.; 2010 p. 457-473.
9. Irie H, Honda H, Aibe H, Kuroiwa T, Yoshimitsu K, Shinozaki K, Yamaguchi K, Shimada M, Masuda K. MR cholangiopancreatographic differentiation of benign and malignant intraductal mucin-producing tumors of the pancreas. AJR Am J Roentgenol 2000 mai;174(5):1403-1408.
10. Manfredi R, Graziani R, Motton M, Mantovani W, Baltieri S, Tognolini A, Crippa S, Capelli P, Salvia R, Pozzi Mucelli R. Main pancreatic duct intraductal papillary mucinous neoplasms: accuracy of MR imaging in differentiation between benign and malignant tumors compared with histopathologic analysis. Radiology 2009 oct;253(1):106-115.
11. Sahani DV, Kadavigere R, Blake M, Fernandez-Del Castillo C, Lauwers GY, Hahn PF. Intraductal papillary mucinous neoplasm of pancreas: multi-detector row CT with 2D curved reformations--correlation with MRCP. Radiology 2006 févr;238(2):560-569.
12. Yamaguchi K, Tanaka M. Mucin-hypersecreting tumor of the pancreas with mucin extrusion through an enlarged papilla. Am. J. Gastroenterol. 1991 juill;86(7):835-839.
13. Song SJ, Lee JM, Kim YJ, Kim SH, Lee JY, Han JK, Choi BI. Differentiation of intraductal papillary mucinous neoplasms from other pancreatic cystic masses: comparison of multirow-detector CT and MR imaging using ROC analysis. J Magn Reson Imaging 2007 juill;26(1):86-93.
14. Sodickson A, Mortele KJ, Barish MA, Zou KH, Thibodeau S, Tempany CMC. Three-dimensional fast-recovery fast spin-echo MRCP: comparison with two-dimensional single-shot fast spin-echo techniques. Radiology 2006 févr;238(2):549-559.
15. Zhang J, Israel GM, Hecht EM, Krinsky GA, Babb JS, Lee VS. Isotropic 3D T2-weighted MR cholangiopancreatography with parallel imaging: feasibility study. AJR Am J Roentgenol 2006 déc;187(6):1564-1570.
16. Vullierme M-P, Giraud-Cohen M, Hammel P, Sauvanet A, Couvelard A, O’Toole D, Levy P, Ruszniewski P, Vilgrain V. Malignant intraductal papillary mucinous neoplasm of the pancreas: in situ versus invasive carcinoma surgical resectability. Radiology 2007 nov;245(2):483-490.
17. Talamini G, Zamboni G, Salvia R, Capelli P, Sartori N, Casetti L, Bovo P, Vaona B, Falconi M, Bassi C, Scarpa A, Vantini I, Pederzoli P. Intraductal papillary mucinous neoplasms and chronic pancreatitis. Pancreatology 2006;6(6):626-634.
18. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, Yamaguchi K, Yamao K, Matsuno S. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006;6(1-2):17-32.
| < Précédent | Suivant > |
|---|





